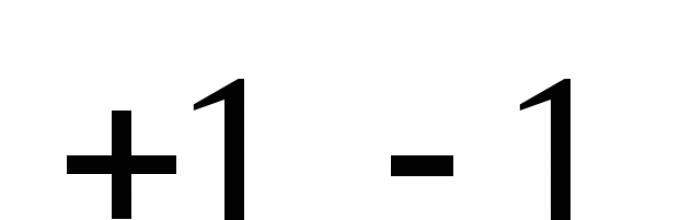Rossiya Federatsiyasi Ta'lim va fan vazirligi
Federal davlat byudjeti oliy kasbiy ta'lim muassasasi
"Sibir davlat sanoat universiteti"
Umumiy va analitik kimyo kafedrasi
Oksidlanish-qaytarilish reaksiyalari
Laboratoriya va amaliy mashg'ulotlarni bajarish bo'yicha ko'rsatmalar
“Kimyo”, “Noorganik kimyo”, fanlaridan
"Umumiy va noorganik kimyo"
Novokuznetsk
UDC 544.3(07)
Sharhlovchi
Kimyo fanlari nomzodi, dotsent,
bosh Fizik kimyo kafedrasi va TMP SibSIU
A.I. Poshevneva
O-504 Oksidlanish-qaytarilish reaksiyalari: usul. farmon. / Sib. davlat sanoat Universitet; komp. : P.G. Permyakov, R.M. Belkina, S.V. Zentsova. - Novokuznetsk: nashriyot uyi. markazi SibGIU 2012. – 41 b.
“Kimyo”, “Noorganik kimyo”, “Umumiy va noorganik kimyo” fanlaridan “Oksidlanish-qaytarilish reaksiyalari” mavzusi bo‘yicha nazariy ma’lumotlar va masalalar yechish misollari keltirilgan. Laboratoriya ishlari va mualliflar jamoasi tomonidan o'z-o'zini nazorat qilish, nazorat va nazorat va mustaqil ishlarni bajarish uchun test topshiriqlari uchun ishlab chiqilgan savollar taqdim etilgan.
Barcha ta'lim yo'nalishlarining birinchi kurs talabalari uchun mo'ljallangan.
Muqaddima
Kimyo fani boʻyicha yoʻriqnomalar oliy taʼlimning texnik yoʻnalishlari dasturiga muvofiq tuzilgan. ta'lim muassasalari, “Oksidlanish-qaytarilish reaksiyalari” mavzusida mustaqil ishlarni tashkil etish uchun mo’ljallangan o'quv materiali sinfda va darsdan tashqari soatlarda.
"Oksidlanish-qaytarilish reaksiyalari" mavzusini o'rganishda mustaqil ish bir nechta elementlardan iborat: nazariy materialni o'rganish, ushbu uslubiy ko'rsatma bo'yicha nazorat va test topshiriqlarini bajarish va o'qituvchi bilan individual maslahatlar.
Mustaqil ish natijasida asosiy atamalar, ta'riflar, tushunchalarni o'zlashtirish va kimyoviy hisoblash texnikasini o'zlashtirish kerak. Nazorat va test topshiriqlarini faqat nazariy materialni chuqur o'rganib chiqqandan va nazariy bo'limda keltirilgan tipik topshiriqlar misollarini to'liq tahlil qilgandan keyingina bajarishni boshlashingiz kerak.
Mualliflar bunga umid qilmoqda ko'rsatmalar talabalarga nafaqat "Oksidlanish-qaytarilish reaktsiyalari" mavzusi bo'yicha taklif qilingan materialni muvaffaqiyatli o'zlashtirishga imkon beradi, balki ular uchun foydali bo'ladi. ta'lim jarayoni"Kimyo", "Noorganik kimyo" fanlarini o'zlashtirishda.
Oksidlanish-qaytarilish reaksiyalari atamalar, ta'riflar, tushunchalar
Oksidlanish-qaytarilish reaksiyalari- bular elektronlarning bir atom yoki iondan boshqasiga o'tishi bilan kechadigan reaktsiyalar, boshqacha aytganda, bular natijasida elementlarning oksidlanish darajalari o'zgaradi.
Oksidlanish holati- molekuladagi barcha bog'lar ionli degan shartli farazdan hisoblangan birikmadagi element atomining zaryadi.
Oksidlanish raqami odatda element belgisi ustidagi arab raqami bilan ko'rsatiladi, raqam oldida ortiqcha yoki minus belgisi mavjud. Masalan, agar HCl molekulasidagi bog'lanish ionli bo'lsa, u holda (+1) va (-1) zaryadli vodorod va xlor ionlari, shuning uchun  .
.

Yuqoridagi qoidalardan foydalanib, K 2 Cr 2 O 7 da xromning, NaClO dagi xlorning, H 2 SO 4 da oltingugurtning, NH 4 NO 2 da azotning oksidlanish darajalarini hisoblaymiz:
 2(+1) + 2 x + 7(–2) = 0, x = +6;
2(+1) + 2 x + 7(–2) = 0, x = +6;
 +1 + x + (–2) = 0, x = +1;
+1 + x + (–2) = 0, x = +1;
 2(+1) + x + 4(–2) = 0, x = +6;
2(+1) + x + 4(–2) = 0, x = +6;
x+4(+1)=+1, y + 2(–2) = –1,
x = –3, y = +3.
Oksidlanish va qaytarilish. Oksidlanish - elektronlarning yo'qolishi, bu elementning oksidlanish darajasining oshishiga olib keladi. Qaytarilish - elektronlarning qo'shilishi, natijada elementning oksidlanish darajasi pasayadi.
Oksidlanish va qaytarilish jarayonlari bir-biri bilan chambarchas bog'liq, chunki kimyoviy tizim elektronlarni faqat boshqa tizim qo'shganda berishi mumkin ( redoks tizimi). Elektron olish tizimi ( oksidlovchi) o'zi qaytariladi (tegishli qaytaruvchiga aylanadi) va elektron beruvchi tizim ( kamaytiruvchi vosita), o'zi oksidlanadi (tegishli oksidlovchi moddaga aylanadi).
1-misol. Reaktsiyani ko'rib chiqing:

Qaytaruvchi (kaliy) atomlari tomonidan berilgan elektronlar soni oksidlovchi (xlor) molekulalari tomonidan qo'shilgan elektronlar soniga teng. Shuning uchun bitta xlor molekulasi ikkita kaliy atomini oksidlashi mumkin. Qabul qilingan va berilgan elektronlar sonini tenglashtirib, biz quyidagilarni olamiz:

Oddiy oksidlovchi moddalarga o'z ichiga oladi:
Elementar moddalar - Cl 2, Br 2, F 2, I 2, O, O 2.
Elementlar eng yuqori oksidlanish darajasini ko'rsatadigan birikmalar (guruh raqami bilan belgilanadi) -

Kation H + va eng yuqori oksidlanish darajasidagi metall ionlari - Sn 4+, Cu 2+, Fe 3+ va boshqalar.
Oddiy qaytaruvchi moddalarga o'z ichiga oladi:
Redoks ikkiligi.Eng yuqori oksidlanish darajasiga ega birikmalar, xos bu element, oksidlanish-qaytarilish reaktsiyalarida faqat oksidlovchi moddalar sifatida harakat qilishi mumkin, bu holda elementning oksidlanish darajasi faqat kamayishi mumkin; Eng past oksidlanish darajasidagi birikmalar aksincha, faqat kamaytiruvchi vositalar bo'lishi mumkin; bu erda elementning oksidlanish darajasi faqat ortishi mumkin. Agar element oraliq oksidlanish holatida bo'lsa, u holda uning atomlari sharoitga qarab, oksidlovchi sifatida ishlaydigan elektronlarni qabul qilishi yoki qaytaruvchi sifatida ishlaydigan elektronlarni berishi mumkin.
Masalan, birikmalardagi azotning oksidlanish darajasi (– 3) dan (+5) gacha (1-rasm):
Faqat NH 3, NH 4 OH
kamaytiruvchi vositalar
HNO3, HNO3 tuzlari
faqat oksidlovchi moddalar
Azotning oraliq oksidlanish darajasiga ega boʻlgan birikmalar oksidlovchi moddalar boʻlib, past oksidlanish darajalariga qaytariladi yoki qaytaruvchi sifatida, yuqori oksidlanish darajasigacha oksidlanadi.
1-rasm - Azot oksidlanish darajasining o'zgarishi
Elektron balans usuli Oksidlanish-qaytarilish reaktsiyalarini tenglashtirish quyidagi qoidani bajarishdan iborat: qaytaruvchi moddalarning barcha zarralari tomonidan berilgan elektronlar soni har doim ma'lum bir reaktsiyada oksidlovchi moddalarning barcha zarralari tomonidan biriktirilgan elektronlar soniga teng.
2-misol.
Elektron muvozanat usulini temirning kislorod bilan oksidlanishi misolida ko'rsatamiz:  .
.
Fe 0 – 3ē = Fe +3 – oksidlanish jarayoni;
O 2 + 4ē = 2O –2 – kamaytirish jarayoni.
Qaytaruvchi vosita tizimida (oksidlanish jarayonining yarim reaksiyasi) temir atomi 3 ta elektronni beradi (A ilovasi).
Oksidlanish tizimida (qaytarilish jarayonining yarim reaktsiyasi) har bir kislorod atomi 2 ta elektronni - jami 4 ta elektronni qabul qiladi.
3 va 4 ikkita sonning eng kichik umumiy karrali 12 ga teng. Demak, temir 12 elektronni, kislorod esa 12 elektronni qabul qiladi:

Tizimlarni yig'ish jarayonida yarim reaksiyalarning chap tomoniga yozilgan 4 va 3 koeffitsientlari yarim reaksiyalarning barcha komponentlariga ko'paytiriladi. Umumiy tenglama ko'rsatilgan tenglamada qancha molekulalar yoki ionlar paydo bo'lishi kerak. Har bir elementning atomlari soni tenglamaning har ikki tomonida bir xil bo'lsa, tenglama to'g'ri bo'ladi.
Yarim reaksiya usuli elektrolitlar eritmalarida sodir bo'ladigan reaktsiyalarni tenglashtirish uchun ishlatiladi. Bunday hollarda reaksiyalarda nafaqat oksidlovchi va qaytaruvchi, balki muhitning zarralari ham ishtirok etadi: suv molekulalari (H 2 O), H + va OH - ionlari. Bunday reaksiyalar uchun elektron-ionli tizimlardan (yarim reaksiyalar) foydalanish to'g'riroq. Suvli eritmalarda yarim reaksiyalarni tuzishda, agar kerak bo'lsa, reaktsiya muhitini hisobga olgan holda H 2 O molekulalari va H + yoki OH - ionlari kiritiladi. Ion sistemalardagi kuchsiz elektrolitlar, kam eriydigan (B ilova) va gazsimon birikmalar molekulyar shaklda yozilgan (ilova C).
Misol sifatida kaliy sulfat va kaliy permanganatning kislotali va ishqoriy muhitdagi o'zaro ta'sirini ko'rib chiqaylik.
3-misol. Kaliy sulfat va kaliy permanganat o'rtasidagi reaktsiya kislotali muhitda:
Elementlarning oksidlanish darajasining o'zgarishini aniqlaymiz va ularni tenglamada ko'rsatamiz. KMnO 4 dagi marganetsning eng yuqori oksidlanish darajasi (+7) KMnO 4 oksidlovchi modda ekanligini ko'rsatadi. K 2 SO 3 birikmasidagi oltingugurt oksidlanish darajasiga ega (+4) - K 2 SO 4 birikmasidagi oltingugurtga (+6) nisbatan qaytarilgan shakldir. Shunday qilib, K 2 SO 3 qaytaruvchi vositadir. Oksidlanish darajasini o'zgartiruvchi elementlarni o'z ichiga olgan haqiqiy ionlar va ularning dastlabki yarim reaktsiyalari olinadi keyingi ko'rinish:

Keyingi harakatlarning maqsadi - reaktsiyaning mumkin bo'lgan yo'nalishini aks ettiruvchi o'qlar o'rniga bu yarim reaktsiyalarda teng belgilar qo'yishdir. Buni har bir yarim reaksiyaning chap va o'ng qismlarida elementlarning turlari, ularning atomlarining soni va barcha zarrachalarning umumiy zaryadlari mos kelganda amalga oshirish mumkin. Bunga erishish uchun muhitning qo'shimcha ionlari yoki molekulalari ishlatiladi. Odatda bu H + ionlari, OH - va suv molekulalari. Yarim reaksiya  marganets atomlari soni bir xil, ammo kislorod atomlari soni teng emas, shuning uchun biz yarim reaksiyaning o'ng tomoniga to'rtta suv molekulasini kiritamiz: . Tizimda shunga o'xshash harakatlarni amalga oshirish (kislorodni tenglashtirish).
marganets atomlari soni bir xil, ammo kislorod atomlari soni teng emas, shuning uchun biz yarim reaksiyaning o'ng tomoniga to'rtta suv molekulasini kiritamiz: . Tizimda shunga o'xshash harakatlarni amalga oshirish (kislorodni tenglashtirish).  , olamiz
, olamiz  . Vodorod atomlari ikkala yarim reaksiyada ham paydo bo'ldi. Ularning soni tenglamalarning boshqa qismida vodorod ionlarining ekvivalent soniga mos keladigan qo'shilishi bilan tenglashtiriladi.
. Vodorod atomlari ikkala yarim reaksiyada ham paydo bo'ldi. Ularning soni tenglamalarning boshqa qismida vodorod ionlarining ekvivalent soniga mos keladigan qo'shilishi bilan tenglashtiriladi.
Endi yarim reaksiya tenglamalariga kiritilgan barcha elementlar tenglashtirildi. Zarrachalarning zaryadlarini tenglashtirish qoladi. Birinchi yarim reaksiyaning o'ng tomonida barcha zaryadlar yig'indisi +2, chap tomonda esa zaryad +7 ga teng. Zaryadlarning tengligi tenglamaning chap tomoniga elektron ko'rinishidagi beshta manfiy zaryadni (+5 ē) qo'shish orqali erishiladi. Xuddi shunday, ikkinchi yarim reaksiya tenglamasida chapdan 2 ē ni ayirish kerak. Endi ikkala yarim reaksiya tenglamalariga teng belgilar qo'yishimiz mumkin:
- tiklanish jarayoni;
- oksidlanish jarayoni.
Ko'rib chiqilayotgan misolda qaytarilish jarayonida qabul qilingan elektronlar sonining oksidlanish vaqtida ajralib chiqqan elektronlar soniga nisbati 5 ga 2 ga teng. Reaksiyaning umumiy tenglamasini olish uchun quyidagi tenglamalarni yig'ish kerak. Qaytarilish va oksidlanish jarayonlari, bu nisbatni hisobga olish uchun - qaytarilish tenglamasini 2 ga, oksidlanish tenglamasini - 5 ga ko'paytiring.
Yarim reaksiya tenglamalarining barcha shartlariga koeffitsientlarni ko'paytirish va ularning faqat o'ng va faqat chap tomonlarini yig'ish orqali biz ion-molekulyar shakldagi yakuniy reaktsiya tenglamasini olamiz:
Bir xil miqdordagi H + ionlari va H 2 O molekulalarini ayirish orqali o'xshash atamalarni qisqartirish orqali biz quyidagilarga erishamiz:
Umumiy ionli tenglama to'g'ri yozilgan, muhit va molekulyar o'rtasida moslik mavjud. Olingan koeffitsientlarni molekulyar tenglamaga o'tkazamiz:
4-misol. Kaliy sulfat va kaliy permanganat o'rtasidagi reaktsiyalar ishqoriy muhitda:
Oksidlanish darajasini o'zgartiruvchi elementlarning oksidlanish darajalarini aniqlaymiz (Mn +7 → Mn +6, S +4 → S +6). Ushbu elementlarni o'z ichiga olgan haqiqiy ionlar (  ,
,
 ). Oksidlanish va qaytarilish jarayonlari (yarim reaksiyalar):
). Oksidlanish va qaytarilish jarayonlari (yarim reaksiyalar):
2 - tiklanish jarayoni
- tiklanish jarayoni
1 - oksidlanish jarayoni
Xulosa tenglama:
Umumiy ionli tenglamada muhitning mosligi mavjud. Koeffitsientlarni molekulyar tenglamaga o'tkazamiz:
Oksidlanish-qaytarilish reaktsiyalari quyidagi turlarga bo'linadi:
molekulalararo oksidlanish-qaytarilish;
o'z-o'zini oksidlanish-o'z-o'zini davolash (nomutanosiblik);
intramolekulyar oksidlanish - qaytarilish.
Molekulalararo oksidlanish-qaytarilish reaksiyalari - bular oksidlovchi bir molekulada va qaytaruvchi boshqa molekulada bo'lgan reaksiyalardir.
5-misol. Temir gidroksidi nam muhitda oksidlanganda quyidagi reaktsiya sodir bo'ladi:

4Fe(OH) 2 + OH – – 1ē = Fe(OH) 3 – oksidlanish jarayoni;
1 O 2 + 2H 2 O + 4ē = 4OH – – qaytarilish jarayoni.
Elektron-ionli tizimlarning to'g'ri yozilganligiga ishonch hosil qilish uchun tekshirish kerak: yarim reaksiyalarning chap va o'ng qismlarida bir xil miqdordagi element atomlari va zaryadlari bo'lishi kerak. Keyin, qabul qilingan va berilgan elektronlar sonini tenglashtirib, biz yarim reaksiyalarni umumlashtiramiz:
4Fe(OH) 2 + 4OH – + O 2 +2H 2 O = 4Fe(OH) 3 + 4OH –
4Fe(OH) 2 + O 2 +2H 2 O = 4Fe(OH) 3
Avtooksidlanish-o'z-o'zini tiklash reaktsiyalari (nomutanosiblik reaktsiyalari) - bu oraliq oksidlanish darajasiga ega bo'lgan elementlar uchun xos bo'lgan elementning umumiy miqdorining bir qismi oksidlanib, boshqa qismi kamayadigan reaktsiyalar.
6-misol. Xlor suv bilan reaksiyaga kirishganda, xlorid va gipoxlor (HClO) kislotalar aralashmasi olinadi:

Bu erda xlor ham oksidlanishga, ham qaytarilishga uchraydi:
1Cl 2 + 2H 2 O – 2ē = 2HClO +2H + – oksidlanish jarayoni;
1 Cl 2 + 2ē = 2Cl – – qaytarilish jarayoni.
2Cl 2 + 2H 2 O = 2HClO + 2HCl
7-misol . Azot kislotasining nomutanosibligi:


Bunday holda oksidlanish va qaytarilish sodir bo'ladi  tarkibida HNO 2:
tarkibida HNO 2:

Xulosa tenglama:
HNO 2 + 2HNO 2 + H 2 O + 2H + = NO  + 3H + + 2NO + 2H 2 O
+ 3H + + 2NO + 2H 2 O
3HNO2 = HNO3 + 2NO + H2O
Molekulyar oksidlanish-qaytarilish reaksiyalari biri bo'lgan jarayondir komponent bir molekula oksidlovchi, ikkinchisi esa qaytaruvchi vosita bo'lib xizmat qiladi. Molekulyar oksidlanish-qaytarilish misollari ko'plab termal dissotsiatsiya jarayonlarini o'z ichiga oladi.
8-misol. NH 4 NO 2 ning termal dissotsiatsiyasi:


Bu erda ion NH dir  oksidlanadi va NO ioni
oksidlanadi va NO ioni  erkin azotga qaytariladi:
erkin azotga qaytariladi:
12NH  – 6 ē = N 2 + 8H +
– 6 ē = N 2 + 8H +
1 2NO  + 8N + + 6 ē = N 2 + 4H 2 O
+ 8N + + 6 ē = N 2 + 4H 2 O
2NH  +2NO
+2NO  + 8H + = N 2 + 8H + + N 2 + 4H 2 O
+ 8H + = N 2 + 8H + + N 2 + 4H 2 O
2NH 4 NO 2 = 2N 2 + 4H 2 O
9-misol . Ammoniy bixromatning parchalanish reaktsiyasi:

12NH  – 6 ē = N 2 + 8H +
– 6 ē = N 2 + 8H +
1 Cr 2 O  + 8N + + 6 ē = Cr 2 O 3 + 4H 2 O
+ 8N + + 6 ē = Cr 2 O 3 + 4H 2 O
2NH  + Cr 2 O
+ Cr 2 O  + 8H + = N 2 + 8H + + Cr 2 O 3 + 4H 2 O
+ 8H + = N 2 + 8H + + Cr 2 O 3 + 4H 2 O
(NH 4) 2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4H 2 O
Oksidlanish darajasini o'zgartiruvchi ikkidan ortiq elementlar ishtirokidagi oksidlanish-qaytarilish reaksiyalari.
10-misol. Masalan, temir sulfidning nitrat kislota bilan reaktsiyasi, bunda reaksiya davomida uchta element (Fe, S, N) oksidlanish darajasini o'zgartiradi:
FeS 2 + HNO 3  Fe 2 (SO 4) 3 + NO + ...
Fe 2 (SO 4) 3 + NO + ...
Tenglama to'liq yozilmagan va elektron-ionli tizimlardan foydalanish (yarim reaksiyalar) tenglamani to'ldirishga imkon beradi. Reaksiyada ishtirok etuvchi elementlarning oksidlanish darajalarini hisobga olib, FeS 2 da ikkita element (Fe, S) oksidlanganligini va oksidlovchi moddani aniqlaymiz.  (
( ), bu NO ga qisqartiriladi:
), bu NO ga qisqartiriladi:
S –1 → 
 (
( )
)
FeS 2 ning oksidlanish yarim reaksiyasini yozamiz:
FeS 2 → Fe 3+ + 
Fe 2 (SO 4) 3 tarkibida ikkita Fe 3+ ionining mavjudligi yarim reaksiyani keyingi yozishda temir atomlari sonini ikki baravar oshirishni taklif qiladi:
2FeS 2 → 2Fe 3+ + 4 
Shu bilan birga, oltingugurt va kislorod atomlari sonini tenglashtiramiz, biz quyidagilarni olamiz:
2FeS 2 + 16H 2 O → 2Fe 3+ + 4  .
.
32 vodorod atomi, 16 H 2 O molekulalarini tenglamaning chap tomoniga kiritish orqali biz tenglamaning o'ng tomoniga vodorod ionlarining ekvivalent sonini (32 H +) qo'shish orqali tenglashtiramiz:
2FeS 2 + 16H 2 O → 2Fe 3+ + 4  + 32H +
+ 32H +
Tenglamaning o'ng tomonidagi zaryad +30 ga teng. Chap tomonda bir xil narsa (+30) bo'lishi uchun 30 ē ni ayirish kerak:
1 2FeS 2 + 16N 2 O – 30 ē = 2Fe 3+ + 4  + 32H + - oksidlanish;
+ 32H + - oksidlanish;
10 YO'Q  + 4N + + 3 ē = NO + 2H 2 O - kamaytirish.
+ 4N + + 3 ē = NO + 2H 2 O - kamaytirish.
2FeS 2 +16H 2 O+10NO  +40H + = 2Fe 3+ + 4
+40H + = 2Fe 3+ + 4  + 32N + + 10NO + 20H 2 O
+ 32N + + 10NO + 20H 2 O
2FeS 2 +10NNO 3 + 30N + = Fe 2 (SO 4) 3 + 10NO +  + 32N + + 4H 2 O
+ 32N + + 4H 2 O
H 2 SO 4 +30H +
Ayirish usuli yordamida tenglamaning ikkala tomonini bir xil miqdordagi ionlarga (30 H +) kamaytiramiz va olamiz:
2FeS 2 +10HNO 3 = Fe 2 (SO 4) 3 + 10NO + H 2 SO 4 + 4H 2 O
Oksidlanish-qaytarilish reaksiyalarining energiyasi . Har qanday jarayonning, shu jumladan oksidlanish-qaytarilish reaktsiyasining o'z-o'zidan paydo bo'lishining sharti ∆G tengsizlikdir.< 0, где ∆G – энергия Гиббса и чем меньше ∆G, т.е. чем больше его отрицательное значение, тем более реакционноспособнее окислительно-восстановительная система. Для реакций окисления-восстановления:
∆G = –n·F·e,
bu erda n - oksidlanish-qaytarilishning elementar aktida qaytaruvchi tomonidan oksidlovchiga o'tkazilgan elektronlar soni;
F - Faraday raqami;
e – oksidlanish-qaytarilish reaksiyasining elektromotor kuchi (EMF).
Oksidlanish-qaytarilish reaktsiyasining elektromotor kuchi oksidlovchi va qaytaruvchi moddalar o'rtasidagi potentsial farq bilan aniqlanadi:
e = E ok – E in,
Standart sharoitlarda:
e ° = E ° ok – E ° in.
Demak, agar jarayonning o'z-o'zidan paydo bo'lishi sharti ∆G ° tengsizlik bo'lsa.< 0, то это возможно, когда n·F·ε ° >0. Agar n va F musbat sonlar bo'lsa, u holda e ° > 0 bo'lishi kerak va bu E ° ok > E ° in bo'lganda mumkin. Bundan kelib chiqadiki, oksidlanish-qaytarilish reaktsiyasining o'z-o'zidan paydo bo'lishi sharti E ° ok > E ° in tengsizlikdir.
11-misol. Oksidlanish-qaytarilish reaksiyasining yuzaga kelish ehtimolini aniqlang:

Oksidlanish darajasini o'zgartiruvchi elementlarning oksidlanish darajalarini aniqlagandan so'ng, biz oksidlovchi va qaytaruvchi moddalarning potentsiallarini ko'rsatgan holda yarim reaktsiyalarini yozamiz:
Su – 2ē = Su 2+ E ° v = +0,34 V
2H + + 2ē = H 2 E ° ok = 0,0 V
Yarim reaksiyalardan ko'rinib turibdiki, E° yaxshi< Е ° в, это говорит о том, что рассматриваемый процесс термодинамически невозможен (∆G ° >0). Bu reaktsiya faqat teskari yo'nalishda mumkin, buning uchun ∆G °< 0.
12-misol. Kaliy permanganatning temir (II) sulfat bilan qaytarilishi uchun Gibbs energiyasi va muvozanat konstantasini hisoblang.
Oksidlovchi va qaytaruvchining yarim reaksiyalari:
2 E ° ok = +1,52V
5 2Fe 2+ – 2 ē = 2Fe 3+ E ° in = +0,77 V
∆G ° = –n·F·e ° = –n·F(E ° ok – E ° in),
Bu yerda n = 10, qaytaruvchi 10 ē dan voz kechganligi sababli, oksidlovchi elementar oksidlanish-qaytarilish aktida 10 ē ni qabul qiladi.
∆G ° = –10·69500(1,52–0,77) = –725000 J,
∆G ° = –725 kJ.
Gibbs energiyasining standart o'zgarishi uning muvozanat konstantasi (K c) bilan bog'liqligini hisobga olsak:
∆G ° = –RTlnK s yoki n·F·e = RTlnK s,
bu erda R = 8,31 J mol –1 K –1,
F  96500 S mol –1, T = 298 K.
96500 S mol –1, T = 298 K.
Ushbu reaktsiya uchun muvozanat konstantasini tenglamaga doimiy qiymatlarni qo'yish, tabiiy logarifmni o'nli kasrga aylantirish orqali aniqlaymiz:

Kc = 10,127.
Olingan ma'lumotlar shuni ko'rsatadiki, ko'rib chiqilayotgan kaliy permanganatning qaytarilish reaktsiyasi reaktiv (∆G ° = – 725 kJ), jarayon chapdan o'ngga boradi va amalda qaytarilmas (K c = 10,127).
Vazifa № 1
Si + HNO 3 + HF → H 2 SiF 6 + NO + …
N +5 + 3e → N +2 │4 qaytarilish reaksiyasi
Si 0 − 4e → Si +4 │3 oksidlanish reaksiyasi
N +5 (HNO 3) – oksidlovchi, Si – qaytaruvchi
3Si + 4HNO 3 + 18HF → 3H 2 SiF 6 + 4NO +8H 2 O
Vazifa № 2
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
B+ HNO 3 + HF → HBF 4 + NO 2 + …
Oksidlovchi va qaytaruvchini aniqlang.
N +5 + 1e → N +4 │3 qaytarilish reaksiyasi
B 0 -3e → B +3 │1 oksidlanish reaktsiyasi
N +5 (HNO 3) - oksidlovchi, B 0 - qaytaruvchi
B+ 3HNO 3 + 4HF → HBF 4 + 3NO 2 + 3H 2 O
Vazifa № 3
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
K 2 Cr 2 O 7 + HCl → Cl 2 + KCl + … + …
Oksidlovchi va qaytaruvchini aniqlang.
2Cl -1 -2e → Cl 2 0 │3 oksidlanish reaksiyasi
Cr +6 (K 2 Cr 2 O 7) – oksidlovchi, Cl -1 (HCl) – qaytaruvchi
K 2 Cr 2 O 7 + 14HCl → 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O
Vazifa № 4
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
Cr 2 (SO 4) 3 + … + NaOH → Na 2 CrO 4 + NaBr + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
Br 2 0 + 2e → 2Br -1 │3 qaytarilish reaksiyasi
2Cr +3 - 6e → 2Cr +6 │1 oksidlanish reaksiyasi
Br 2 - oksidlovchi, Cr +3 (Cr 2 (SO 4) 3) - qaytaruvchi
Cr 2 (SO 4) 3 + 3Br 2 + 16NaOH → 2Na 2 CrO 4 + 6NaBr + 3Na 2 SO 4 + 8H 2 O
Vazifa № 5
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
K 2 Cr 2 O 7 + … + H 2 SO 4 → l 2 + Cr 2 (SO 4) 3 + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
2Cr +6 + 6e → 2Cr +3 │1 qaytarilish reaksiyasi
2I -1 -2e → l 2 0 │3 oksidlanish reaksiyasi
Cr +6 (K 2 Cr 2 O 7) – oksidlovchi, l -1 (Hl) – qaytaruvchi
K 2 Cr 2 O 7 + 6HI + 4H 2 SO 4 → 3l 2 + Cr 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O
Vazifa № 6
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
H 2 S + HMnO 4 → S + MnO 2 + …
Oksidlovchi va qaytaruvchini aniqlang.
3H 2 S + 2HMnO 4 → 3S + 2MnO 2 + 4H 2 O
Vazifa № 7
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
H 2 S + HClO 3 → S + HCl + …
Oksidlovchi va qaytaruvchini aniqlang.
S -2 -2e → S 0 │3 oksidlanish reaksiyasi
Mn +7 (HMnO 4) – oksidlovchi, S -2 (H 2 S) – qaytaruvchi
3H 2 S + HClO 3 → 3S + HCl + 3H 2 O
Vazifa № 8
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
NO + HClO 4 + … → HNO 3 + HCl
Oksidlovchi va qaytaruvchini aniqlang.
Cl +7 + 8e → Cl -1 │3 qaytarilish reaksiyasi
N +2 -3e → N +5 │8 oksidlanish reaksiyasi
Cl +7 (HClO 4) - oksidlovchi, N +2 (NO) - qaytaruvchi
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
Vazifa № 9
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KMnO 4 + H 2 S + H 2 SO 4 → MnSO 4 + S + … + …
Oksidlovchi va qaytaruvchini aniqlang.
S -2 -2e → S 0 │5 oksidlanish reaksiyasi
Mn +7 (KMnO 4) – oksidlovchi, S -2 (H 2 S) – qaytaruvchi
2KMnO 4 + 5H 2 S + 3H 2 SO 4 → 2MnSO 4 + 5S + K 2 SO 4 + 8H 2 O
Vazifa № 10
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KMnO 4 + KBr + H 2 SO 4 → MnSO 4 + Br 2 + … + …
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 5e → Mn +2 │2 qaytarilish reaksiyasi
2Br -1 -2e → Br 2 0 │5 oksidlanish reaksiyasi
Mn +7 (KMnO 4) – oksidlovchi, Br -1 (KBr) – qaytaruvchi
2KMnO 4 + 10KBr + 8H 2 SO 4 → 2MnSO 4 + 5Br 2 + 6K 2 SO 4 + 8H 2 O
Vazifa № 11
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
PH 3 + HClO 3 → HCl + …
Oksidlovchi va qaytaruvchini aniqlang.
Cl +5 + 6e → Cl -1 │4 qaytarilish reaksiyasi
Cl +5 (HClO 3) - oksidlovchi, P -3 (H 3 PO 4) - qaytaruvchi
3PH 3 + 4HClO 3 → 4HCl + 3H 3 PO 4
Vazifa № 12
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
PH 3 + HMnO 4 → MnO 2 + … + …
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 3e → Mn +4 │8 qaytarilish reaksiyasi
P -3 - 8e → P +5 │3 oksidlanish reaktsiyasi
Mn +7 (HMnO 4) - oksidlovchi, P -3 (H 3 PO 4) - qaytaruvchi
3PH 3 + 8HMnO 4 → 8MnO 2 + 3H 3 PO 4 + 4H 2 O
Vazifa № 13
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
NO + KClO + … → KNO 3 + KCl + …
Oksidlovchi va qaytaruvchini aniqlang.
Cl +1 + 2e → Cl -1 │3 qaytarilish reaksiyasi
N +2 - 3e → N +5 │2 oksidlanish reaktsiyasi
Cl +1 (KClO) - oksidlovchi, N +2 (NO) - qaytaruvchi
2NO + 3KClO + 2KOH → 2KNO 3 + 3KCl + H 2 O
Vazifa № 14
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
PH 3 + AgNO 3 + … → Ag + … + HNO 3
Oksidlovchi va qaytaruvchini aniqlang.
Ag +1 + 1e → Ag 0 │8 qaytarilish reaksiyasi
P -3 - 8e → P +5 │1 oksidlanish reaktsiyasi
Ag +1 (AgNO 3) - oksidlovchi, P -3 (PH 3) - qaytaruvchi
PH 3 + 8AgNO 3 + 4H 2 O → 8Ag + H 3 PO 4 + 8HNO 3
Vazifa № 15
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KNO 2 + … + H 2 SO 4 → I 2 + NO + … + …
Oksidlovchi va qaytaruvchini aniqlang.
N +3 + 1e → N +2 │ 2 qaytarilish reaksiyasi
2I -1 − 2e → I 2 0 │ 1 oksidlanish reaksiyasi
N +3 (KNO 2) - oksidlovchi, I -1 (HI) - qaytaruvchi
2KNO 2 + 2HI + H 2 SO 4 → I 2 + 2NO + K 2 SO 4 + 2H 2 O
Vazifa № 16
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
Na 2 SO 3 + Cl 2 + … → Na 2 SO 4 + …
Oksidlovchi va qaytaruvchini aniqlang.
Cl 2 0 + 2e → 2Cl -1 │1 qaytarilish reaksiyasi
Cl 2 0 – oksidlovchi, S +4 (Na 2 SO 3) – qaytaruvchi
Na 2 SO 3 + Cl 2 + H 2 O → Na 2 SO 4 + 2HCl
17-sonli vazifa
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KMnO 4 + MnSO 4 + H 2 O→ MnO 2 + … + …
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 3e → Mn +4 │2 qaytarilish reaksiyasi
Mn +2 - 2e → Mn +4 │3 oksidlanish reaksiyasi
Mn +7 (KMnO 4) - oksidlovchi, Mn +2 (MnSO 4) - qaytaruvchi
2KMnO 4 + 3MnSO 4 + 2H 2 O → 5MnO 2 + K 2 SO 4 + 2H 2 SO 4
Vazifa № 18
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KNO 2 + … + H 2 O → MnO 2 + … + KOH
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 3e → Mn +4 │2 qaytarilish reaksiyasi
N +3 - 2e → N +5 │3 oksidlanish reaksiyasi
Mn +7 (KMnO 4) - oksidlovchi, N +3 (KNO 2) - qaytaruvchi
3KNO 2 + 2KMnO 4 + H 2 O → 2MnO 2 + 3KNO 3 + 2KOH
Vazifa № 19
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
Cr 2 O 3 + … + KOH → KNO 2 + K 2 CrO 4 + …
Oksidlovchi va qaytaruvchini aniqlang.
N +5 + 2e → N +3 │3 qaytarilish reaksiyasi
2Cr +3 − 6e → 2Cr +6 │1 oksidlanish reaksiyasi
N +5 (KNO 3) - oksidlovchi, Cr +3 (Cr 2 O 3) - qaytaruvchi
Cr 2 O 3 + 3KNO 3 + 4KOH → 3KNO 2 +2K 2 CrO 4 + 2H 2 O
Vazifa № 20
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
I 2 + K 2 SO 3 + … → K 2 SO 4 + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
I 2 0 + 2e → 2I -1 │1 qaytarilish reaksiyasi
S +4 - 2e → S +6 │1 oksidlanish reaksiyasi
I 2 – oksidlovchi, S +4 (K 2 SO 3) – qaytaruvchi
I 2 + K 2 SO 3 +2KOH → K 2 SO 4 +2KI + H 2 O
Vazifa № 21
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KMnO 4 + NH 3 → MnO 2 +N 2 + … + …
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 3e → Mn +4 │2 qaytarilish reaksiyasi
2N -3 - 6e → N 2 0 │1 oksidlanish reaksiyasi
Mn +7 (KMnO 4) - oksidlovchi, N -3 (NH 3) - qaytaruvchi
2KMnO 4 + 2NH 3 → 2MnO 2 +N 2 + 2KOH + 2H 2 O
Vazifa № 22
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
NO 2 + P 2 O 3 + … → NO + K 2 HPO 4 + …
Oksidlovchi va qaytaruvchini aniqlang.
N +4 + 2e → N +2 │2 qaytarilish reaksiyasi
2P +3 - 4e → 2P +5 │1 oksidlanish reaktsiyasi
N +4 (NO 2) - oksidlovchi, P +3 (P 2 O 3) - qaytaruvchi
2NO 2 + P 2 O 3 + 4KOH → 2NO + 2K 2 HPO 4 + H 2 O
Vazifa № 23
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KI + H 2 SO 4 → I 2 + H 2 S + … + …
Oksidlovchi va qaytaruvchini aniqlang.
S +6 + 8e → S -2 │1 qaytarilish reaksiyasi
2I -1 − 2e → I 2 0 │4 oksidlanish reaksiyasi
S +6 (H 2 SO 4) – oksidlovchi, I -1 (KI) – qaytaruvchi
8KI + 5H 2 SO 4 → 4I 2 + H 2 S + 4K 2 SO 4 + 4H 2 O
Vazifa № 24
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
FeSO 4 + ... + H 2 SO 4 → ... + MnSO 4 + K 2 SO 4 + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 5e → Mn +2 │2 qaytarilish reaksiyasi
2Fe +2 − 2e → 2Fe +3 │5 oksidlanish reaksiyasi
Mn +7 (KMnO 4) - oksidlovchi, Fe +2 (FeSO 4) - qaytaruvchi
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 → 5Fe 2 (SO 4) 3 + 2MnSO 4 + K 2 SO 4 + 8H 2 O
Vazifa № 25
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
Na 2 SO 3 + … + KOH → K 2 MnO 4 + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 1e → Mn +6 │2 qaytarilish reaksiyasi
S +4 - 2e → S +6 │1 oksidlanish reaksiyasi
Mn +7 (KMnO 4) – oksidlovchi, S +4 (Na 2 SO 3) – qaytaruvchi
Na 2 SO 3 + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
Vazifa № 26
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
H 2 O 2 + … + H 2 SO 4 → O 2 + MnSO 4 + … + …
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 5e → Mn +2 │2 qaytarilish reaksiyasi
2O -1 - 2e → O 2 0 │5 oksidlanish reaksiyasi
Mn +7 (KMnO 4) - oksidlovchi, O -1 (H 2 O 2) - qaytaruvchi
5H 2 O 2 + 2KMnO 4 + 3H 2 SO 4 → 5O 2 + 2MnSO 4 + K 2 SO 4 + 8H 2 O
Vazifa № 27
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
K 2 Cr 2 O 7 + H 2 S + H 2 SO 4 → Cr 2 (SO 4) 3 + K 2 SO 4 + … + …
Oksidlovchi va qaytaruvchini aniqlang.
2Cr +6 + 6e → 2Cr +3 │1 qaytarilish reaksiyasi
S -2 - 2e → S 0 │3 oksidlanish reaksiyasi
Cr +6 (K 2 Cr 2 O 7) – oksidlovchi, S -2 (H 2 S) – qaytaruvchi
K 2 Cr 2 O 7 + 3H 2 S + 4H 2 SO 4 → Cr 2 (SO 4) 3 + K 2 SO 4 + 3S + 7H 2 O
Vazifa № 28
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KMnO 4 + HCl → MnCl 2 + Cl 2 + … + …
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 5e → Mn +2 │2 qaytarilish reaksiyasi
2Cl -1 − 2e → Cl 2 0 │5 oksidlanish reaksiyasi
Mn +7 (KMnO 4) - oksidlovchi, Cl -1 (HCl) - qaytaruvchi
2KMnO 4 + 16HCl → 2MnCl 2 + 5Cl 2 + 2KCl + 8H 2 O
Vazifa № 29
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
CrCl 2 + K 2 Cr 2 O 7 + … → CrCl 3 + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
2Cr +6 + 6e → 2Cr +3 │1 qaytarilish reaksiyasi
Cr +2 - 1e → Cr +3 │6 oksidlanish reaksiyasi
Cr +6 (K 2 Cr 2 O 7) - oksidlovchi, Cr +2 (CrCl 2) - qaytaruvchi
6CrCl 2 + K 2 Cr 2 O 7 + 14HCl → 8CrCl 3 + 2KCl + 7H 2 O
Vazifa № 30
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
K 2 CrO 4 + HCl → CrCl 3 + … + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
Cr +6 + 3e → Cr +3 │2 qaytarilish reaksiyasi
2Cl -1 − 2e → Cl 2 0 │3 oksidlanish reaksiyasi
Cr +6 (K 2 CrO 4) – oksidlovchi, Cl -1 (HCl) – qaytaruvchi
2K 2 CrO 4 + 16HCl → 2CrCl 3 + 3Cl 2 + 4KCl + 8H 2 O
31-sonli vazifa
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
KI + … + H 2 SO 4 → I 2 + MnSO 4 + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
Mn +7 + 5e → Mn +2 │2 qaytarilish reaksiyasi
2l -1 − 2e → l 2 0 │5 oksidlanish reaksiyasi
Mn +7 (KMnO 4) – oksidlovchi, l -1 (Kl) – qaytaruvchi
10KI + 2KMnO 4 + 8H 2 SO 4 → 5I 2 + 2MnSO 4 + 6K 2 SO 4 + 8H 2 O
32-sonli vazifa
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
FeSO 4 + KClO 3 + KOH → K 2 FeO 4 + KCl + K 2 SO 4 + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
Cl +5 + 6e → Cl -1 │2 qaytarilish reaksiyasi
Fe +2 − 4e → Fe +6 │3 oksidlanish reaksiyasi
3FeSO 4 + 2KClO 3 + 12KOH → 3K 2 FeO 4 + 2KCl + 3K 2 SO 4 + 6H 2 O
Vazifa № 33
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing:
FeSO 4 + KClO 3 + … → Fe 2 (SO 4) 3 + … + H 2 O
Oksidlovchi va qaytaruvchini aniqlang.
Cl +5 + 6e → Cl -1 │1 qaytarilish reaksiyasi
2Fe +2 − 2e → 2Fe +3 │3 oksidlanish reaksiyasi
Cl +5 (KClO 3) - oksidlovchi, Fe +2 (FeSO 4) - qaytaruvchi
6FeSO 4 + KClO 3 + 3H 2 SO 4 → 3Fe 2 (SO 4) 3 + KCl + 3H 2 O
Vazifa № 34
Elektron muvozanat usulidan foydalanib, reaksiya tenglamasini tuzing.
Oksidlanish darajasining oshishi bilan oksidlanish jarayoni sodir bo'ladi va moddaning o'zi qaytaruvchi vositadir. Oksidlanish darajasi pasayganda, qaytarilish jarayoni sodir bo'ladi va moddaning o'zi oksidlovchi vositadir.
ORR ni tenglashtirishning tavsiflangan usuli "oksidlanish darajasi bo'yicha muvozanat usuli" deb ataladi.
Ko'pgina kimyo darsliklarida keltirilgan va amaliyotda keng qo'llaniladi elektron balans usuli ORR ni tenglashtirish uchun oksidlanish darajasi zaryadga teng emasligi haqidagi ogohlantirishlar bilan foydalanish mumkin.
2. Yarim reaksiya usuli.
Bunday hollarda, suvli eritmada (eritma) reaktsiya sodir bo'lganda, tenglamalarni tuzishda ular reaksiyaga kirishuvchi moddalarni tashkil etuvchi atomlarning oksidlanish darajasining o'zgarishidan emas, balki haqiqiy zarrachalar zaryadlarining o'zgarishidan kelib chiqadi, ya'ni. , ular eritmadagi moddalarning mavjudligi shaklini (oddiy yoki murakkab ion, atom yoki suvda erimagan yoki zaif dissotsiatsiyalanuvchi moddaning molekulasi) hisobga oladi.
Ushbu holatda Oksidlanish-qaytarilish reaksiyalarining ionli tenglamalarini tuzayotganda, almashinish xususiyatiga ega ionli tenglamalar uchun qabul qilingan yozuv shakliga amal qilish kerak, ya'ni: yomon eriydigan, ozgina dissotsilangan va gazsimon birikmalar molekulyar shaklda yozilishi kerak va ionlar ularning holatini o'zgartirmaslik tenglamadan chiqarilishi kerak. Bunda oksidlanish va qaytarilish jarayonlari alohida yarim reaksiyalar shaklida qayd etiladi. Ularni har bir turdagi atomlar soni bo'yicha tenglashtirgandan so'ng, yarim reaksiyalar qo'shiladi, ularning har birini oksidlovchi va qaytaruvchi moddaning zaryadini o'zgartirishni tenglashtiruvchi koeffitsientga ko'paytiriladi.
Yarim reaksiya usuli moddalarning oksidlanish-qaytarilish reaksiyalari vaqtidagi haqiqiy o‘zgarishlarini aniqroq aks ettiradi va bu jarayonlar uchun ion-molekulyar shaklda tenglamalar tuzishni osonlashtiradi.
Chunki xuddi shunday reaktivlar olish mumkin turli mahsulotlar muhitning tabiatiga qarab (kislotali, ishqoriy, neytral), ionli sxemadagi bunday reaktsiyalar uchun oksidlovchi va qaytaruvchi vosita funktsiyalarini bajaradigan zarralardan tashqari, muhitning reaktsiyasini tavsiflovchi zarracha bo'lishi kerak. ko'rsatilgan (ya'ni, H + ioni yoki OH - ioni yoki H molekulasi 2 O).
5-misol. Yarim reaksiya usulidan foydalanib, reaksiyadagi koeffitsientlarni tartibga soling:
KMnO 4 + KNO 2 + H 2 SO 4 ® MnSO 4 + KNO 3 + K 2 SO 4 + H 2 O.
Yechim. Suvdan tashqari barcha moddalar ionlarga ajralishini hisobga olib, reaktsiyani ion shaklida yozamiz:
MnO 4 - + NO 2 - + 2H + ® Mn 2+ + NO 3 - + H 2 O
(K + va SO 4 2 - o'zgarishsiz qoladi, shuning uchun ular ion sxemasida ko'rsatilmagan). Ion diagrammasidan oksidlovchi vosita ekanligi aniq permanganat ioni(MnO 4 -) Mn 2+ ioniga aylanadi va to'rtta kislorod atomi ajralib chiqadi.
Kislotali muhitda Oksidlovchi vosita tomonidan chiqarilgan har bir kislorod atomi 2H + ga bog'lanib, suv molekulasini hosil qiladi.
U ergashadi: MnO 4 - + 8H + + 5® Mn 2+ + 4H 2 O.
Mahsulotlar va reagentlarning zaryadlaridagi farqni topamiz: Dq = +2-7 = -5 ("-" belgisi qaytarilish jarayoni sodir bo'layotganligini va reaktivlarga 5 qo'shilganligini bildiradi). Ikkinchi jarayon uchun NO 2 ni NO 3 ga aylantirish, etishmayotgan kislorod suvdan qaytaruvchiga keladi va natijada H + ionlarining ortiqcha miqdori hosil bo'ladi, bu holda reagentlar 2 ni yo'qotadi :
NO 2 - + H 2 O - 2® NO 3 - + 2H +.
Shunday qilib, biz quyidagilarni olamiz:
2 | MnO 4 - + 8H + + 5® Mn 2+ + 4H 2 O (qaytarilish),
5 | NO 2 - + H 2 O - 2® NO 3 - + 2H + (oksidlanish).
Birinchi tenglamaning shartlarini 2 ga, ikkinchisini 5 ga ko'paytirsak va ularni qo'shsak, biz hosil bo'lamiz. ion-molekulyar tenglama bu reaktsiya:
2MnO 4 - + 16H + + 5NO 2 - + 5H 2 O = 2Mn 2+ + 8H 2 O + 5NO 3 - + 10H +.
Tenglamaning chap va o'ng tomonidagi bir xil zarrachalarni bekor qilish orqali biz nihoyat ion-molekulyar tenglamani olamiz:
2MnO 4 - + 5NO 2 - + 6H + = 2Mn 2+ + 5NO 3 - + 3H 2 O.
tomonidan ionli tenglama Keling, molekulyar tenglama tuzamiz:
2KMnO 4 + 5KNO 2 + 3H 2 SO 4 = 2MnSO 4 + 5KNO 3 + K 2 SO 4 + 3H 2 O.
Ishqoriy va neytral muhitda rahbarlik qilish mumkin quyidagi qoidalar: ishqoriy va neytral muhitda oksidlovchi moddadan ajralib chiqqan har bir kislorod atomi bitta suv molekulasi bilan birikib, ikkita gidroksid ionini (2OH -) hosil qiladi va har bir etishmayotgani 2 OH - ionidan qaytaruvchiga o'tib, bitta suv molekulasini hosil qiladi. ishqoriy muhitda , va neytral u 2 H + ionlari chiqishi bilan suvdan keladi.
Agar Oksidlanish-qaytarilish reaksiyasida ishtirok etadi vodorod periks(H 2 O 2), ma'lum bir reaktsiyada H 2 O 2 rolini hisobga olish kerak. H 2 O 2 da kislorod oraliq oksidlanish holatida (-1) bo'ladi, shuning uchun vodorod periks oksidlanish-qaytarilish reaktsiyalarida redoks ikkilikni namoyon qiladi. H 2 O 2 bo'lgan hollarda oksidlovchi vosita, yarim reaksiyalar quyidagi shaklga ega:
H 2 O 2 + 2H + + 2? ® 2H 2 O (kislotali muhit);
H 2 O 2 +2? ® 2OH - (neytral va ishqoriy muhitlar).
Agar vodorod periks bo'lsa kamaytiruvchi vosita:
H 2 O 2 - 2? ® O 2 + 2H + (kislotali muhit);
H 2 O 2 + 2OH - - 2? ® O 2 + 2H 2 O (ishqoriy va neytral).
6-misol. Reaksiyani tenglashtiring: KI + H 2 O 2 + H 2 SO 4 ® I 2 + K 2 SO 4 + H 2 O.
Yechim. Reaksiyani ion shaklida yozamiz:
I - + H 2 O 2 + 2H + ® I 2 + SO 4 2 - + H 2 O.
Ushbu reaktsiyada H2O2 oksidlovchi vosita ekanligini va reaktsiya kislotali muhitda borishini hisobga olgan holda yarim reaktsiyalarni tuzamiz:
1 2I - - 2= I 2 ,
1 H 2 O 2 + 2H + + 2® 2H 2 O.
Yakuniy tenglama: 2KI + H 2 O 2 + H 2 SO 4 ® I 2 + K 2 SO 4 + 2H 2 O.
Redoks reaktsiyalarining to'rt turi mavjud:
1 . Molekulalararo turli moddalarni tashkil etuvchi elementlar atomlarining oksidlanish darajalari o'zgargan oksidlanish-qaytarilish reaksiyalari. 2-6-misollarda muhokama qilingan reaksiyalar bu turga tegishli.
2 . Intramolekulyar Oksidlanish darajasi bir moddaning turli elementlarining atomlarini o'zgartiradigan redoks reaktsiyalari. Aralashmalarning termik parchalanish reaksiyalari shu mexanizm orqali boradi. Masalan, reaktsiyada
Pb(NO 3) 2 ® PbO + NO 2 + O 2
azotning (N +5 ® N +4) va Pb(NO 3) 2 molekulasi ichida joylashgan kislorod atomining (O - 2 ® O 2 0) oksidlanish holatini o'zgartiradi.
3. O'z-o'zini oksidlanish-o'z-o'zini tiklash reaktsiyalari(nomutanosiblik, dismutatsiya). Bunda bir xil elementning oksidlanish darajasi ham ortadi, ham kamayadi. Nomutanosiblik reaksiyalari elementning oraliq oksidlanish darajalaridan biriga mos keladigan birikmalar yoki moddalar elementlariga xosdir.
7-misol. Yuqoridagi barcha usullardan foydalanib, reaktsiyani tenglashtiring:
Yechim.
A) Oksidlanish holati balansi usuli.
Reaksiyadan oldin va keyin oksidlanish-qaytarilish jarayonida ishtirok etuvchi elementlarning oksidlanish darajalarini aniqlaymiz:
K 2 MnO 4 + H 2 O ® KMnO 4 + MnO 2 + KOH.
Oksidlanish darajalarini taqqoslashdan marganets bir vaqtning o'zida oksidlanish jarayonida ishtirok etadi, oksidlanish darajasini +6 dan +7 gacha oshiradi va qaytarilish jarayonida oksidlanish darajasini +6 dan +4,2 Mn +6 ® Mn gacha kamaytiradi. +7; Dw = 7-6 = +1 (oksidlanish jarayoni, qaytaruvchi),
1 Mn +6 ® Mn +4; Dw = 4-6 = -2 (qaytarilish jarayoni, oksidlovchi vosita).
Bu reaksiyada oksidlovchi va qaytaruvchi bir xil modda (K 2 MnO 4) bo'lganligi sababli, uning oldidagi koeffitsientlar umumlashtiriladi. Biz tenglamani yozamiz:
3K 2 MnO 4 + 2H 2 O = 2KMnO 4 + MnO 2 + 4KOH.
b) Yarim reaksiya usuli.
Reaktsiya neytral muhitda sodir bo'ladi. Biz H 2 O zaif elektrolit, MnO 2 esa suvda yomon eriydigan oksid ekanligini hisobga olib, ion reaktsiyasi sxemasini tuzamiz:
MnO 4 2 - + H 2 O ® MnO 4 - + ¯MnO 2 + OH - .
Yarim reaksiyalarni yozamiz:
2 MnO 4 2 - - ? ® MnO 4 - (oksidlanish),
1 MnO 4 2 - + 2H 2 O + 2? ® MnO 2 + 4OH - (kamaytirish).
Biz koeffitsientlarga ko'paytiramiz va ikkala yarim reaktsiyani qo'shamiz, biz umumiy ion tenglamasini olamiz:
3MnO 4 2 - + 2H 2 O = 2MnO 4 - + MnO 2 + 4OH -.
Molekulyar tenglama: 3K 2 MnO 4 + 2H 2 O = 2KMnO 4 + MnO 2 + 4KOH.
Bunday holda, K 2 MnO 4 ham oksidlovchi, ham qaytaruvchi vositadir.
4. Molekulyar oksidlanish-qaytarilish reaktsiyalari, ularda bir xil element atomlarining oksidlanish darajalari tenglashtiriladi (ya'ni, oldin muhokama qilinganlarning teskarisi). qarama-qarshi nomutanosiblik(almashtirish), masalan
NH 4 NO 2 ® N 2 + 2H 2 O.
1 2N - 3 - 6? ® N 2 0 (oksidlanish jarayoni, qaytaruvchi),
1 2N +3 + 6?® N 2 0 (qaytarilish jarayoni, oksidlovchi modda).
Eng qiyinlari bir emas, balki ikki yoki undan ortiq elementlarning atomlari yoki ionlari bir vaqtning o'zida oksidlangan yoki qaytariladigan oksidlanish-qaytarilish reaktsiyalari.
8-misol. Yuqoridagi usullardan foydalanib, reaktsiyani tenglashtiring:
3 -2 +5 +5 +6 +2
2 S 3 + HNO 3 ® H 3 AsO 4 + H 2 SO 4 + NO sifatida.
Eritma bilan oksidlanish-qaytarilish reaktsiyalariga misollar keltirishdan oldin, biz ushbu transformatsiyalar bilan bog'liq asosiy ta'riflarni ajratib ko'rsatamiz.
O'zaro ta'sir qilish paytida oksidlanish darajasini pasaytirish (elektronlarni qabul qilish) bilan o'zgartiradigan atomlar yoki ionlar oksidlovchi moddalar deb ataladi. Bunday xususiyatlarga ega bo'lgan moddalar orasida kuchli noorganik kislotalar mavjud: sulfat, xlorid, azot.
Oksidlovchi
Shuningdek kuchli oksidlovchi moddalar ishqoriy metallarning permanganatlar va xromatlarini o'z ichiga oladi.
Oksidlovchi energiya darajasini to'ldirishdan oldin (tugallangan konfiguratsiyani o'rnatish) reaktsiya paytida kerakli narsani qabul qiladi.
Qaytaruvchi vosita
Har qanday redoks reaktsiyasi sxemasi qaytaruvchi vositani aniqlashni o'z ichiga oladi. U o'zaro ta'sir paytida oksidlanish darajasini oshirishi mumkin bo'lgan ionlar yoki neytral atomlarni o'z ichiga oladi (ular elektronlarni boshqa atomlarga beradi).
Odatda qaytaruvchi moddalarga metall atomlari kiradi.
OVRdagi jarayonlar
Ular boshlang'ich moddalarning oksidlanish darajasining o'zgarishi bilan yana nima bilan tavsiflanadi.
Oksidlanish salbiy zarralarni chiqarish jarayonini o'z ichiga oladi. Qaytarilish ularni boshqa atomlardan (ionlardan) qabul qilishni o'z ichiga oladi.

Tahlil qilish algoritmi
Eritmalar bilan oksidlanish-qaytarilish reaktsiyalariga misollar o'rta maktab o'quvchilarini yakuniy kimyo testlariga tayyorlash uchun mo'ljallangan turli xil ma'lumotnomalarda keltirilgan.
OGEda taklif qilinganlarni muvaffaqiyatli engish uchun va Yagona davlat imtihon topshiriqlari, oksidlanish-qaytarilish jarayonlarini kompilyatsiya qilish va tahlil qilish algoritmini o'zlashtirish muhimdir.
- Avvalo, diagrammada taklif qilingan moddalardagi barcha elementlarga zaryad qiymatlari beriladi.
- Reaksiyaning chap tomonidagi atomlar (ionlar) yoziladi, ular o'zaro ta'sir davomida ko'rsatkichlarini o'zgartiradilar.
- Oksidlanish darajasi oshganda “-” belgisi, oksidlanish darajasi pasayganda “+” belgisi ishlatiladi.
- Eng kichik umumiy ko'paytma (ular qoldiqsiz bo'lingan son) berilgan va qabul qilingan elektronlar o'rtasida aniqlanadi.
- NOCni elektronlarga bo'lishda biz stereokimyoviy koeffitsientlarni olamiz.
- Ularni tenglamadagi formulalar oldiga joylashtiramiz.
OGE dan birinchi misol
To'qqizinchi sinfda barcha o'quvchilar oksidlanish-qaytarilish reaktsiyalarini qanday echishni bilishmaydi. Shuning uchun ular ko'p xatolarga yo'l qo'yishadi va OGE uchun yuqori ball olishmaydi. Harakatlar algoritmi yuqorida keltirilgan, endi uni ishlab chiqishga harakat qilaylik aniq misollar.

Ta'limning asosiy bosqichi bitiruvchilariga taklif etilayotgan reaksiyada koeffitsientlarni joylashtirish bo'yicha topshiriqlarning o'ziga xosligi shundaki, tenglamaning chap va o'ng tomonlari ham berilgan.
Bu vazifani sezilarli darajada osonlashtiradi, chunki siz o'zaro ta'sir mahsulotlarini mustaqil ravishda ixtiro qilishingiz yoki etishmayotgan boshlang'ich moddalarni tanlashingiz shart emas.
Masalan, reaktsiyadagi koeffitsientlarni aniqlash uchun elektron balansdan foydalanish taklif etiladi:
Bir qarashda bu reaksiya stereokimyoviy koeffitsientlarni talab qilmaydi. Biroq, sizning nuqtai nazaringizni tasdiqlash uchun barcha elementlarda zaryad raqamlari bo'lishi kerak.
Mis oksidi (2) va temir oksidi (2) ni o'z ichiga olgan ikkilik birikmalarda oksidlanish darajalarining yig'indisi nolga teng, chunki kislorod uchun -2, mis va temir uchun bu ko'rsatkich +2 ga teng. Oddiy moddalar elektronlardan voz kechmaydi (qabul qilmaydi), shuning uchun ular nol oksidlanish darajasi bilan tavsiflanadi.
O'zaro ta'sir davomida qabul qilingan va berilgan elektronlar sonini "+" va "-" belgilari bilan ko'rsatib, elektron balans tuzamiz.
Fe 0 -2e=Fe 2+.
O'zaro ta'sir davomida qabul qilingan va berilgan elektronlar soni bir xil bo'lganligi sababli, eng kichik umumiy ko'paytmani topish, stereokimyoviy koeffitsientlarni aniqlash va ularni taklif qilingan o'zaro ta'sir sxemasiga qo'yishning ma'nosi yo'q.
Topshiriq bo'yicha maksimal ball olish uchun eritmalar bilan oksidlanish-qaytarilish reaktsiyalariga misollar yozish kerak emas, balki oksidlovchi (CuO) va qaytaruvchi (Fe) formulalarini alohida yozish kerak.

OGE bilan ikkinchi misol
Keling, yakuniy imtihon sifatida kimyoni tanlagan 9-sinf o'quvchilari duch kelishi mumkin bo'lgan eritmalar bilan oksidlanish-qaytarilish reaktsiyalariga ko'proq misollar keltiramiz.
Aytaylik, koeffitsientlarni tenglamaga joylashtirish taklif qilinsin:
Na+HCl=NaCl+H2.
Vazifani bajarish uchun birinchi navbatda har bir oddiy va murakkab moddaning oksidlanish darajalarini aniqlash kerak. Natriy va vodorod uchun ular nolga teng bo'ladi, chunki ular oddiy moddalardir.
IN xlorid kislotasi Vodorod ijobiy oksidlanish darajasiga ega, xlor esa manfiy oksidlanish darajasiga ega. Koeffitsientlarni tartibga solgandan so'ng, biz koeffitsientlar bilan reaksiyaga ega bo'lamiz.
Yagona davlat imtihonidan birinchi
Oksidlanish-qaytarilish reaktsiyalarini qanday to'ldirish kerak? Yagona davlat imtihonida (11-sinf) topilgan echimlar bilan misollar bo'shliqlarni to'ldirishni, shuningdek koeffitsientlarni joylashtirishni talab qiladi.
Masalan, reaktsiyani elektron balans bilan to'ldirishingiz kerak:
H 2 S+ HMnO 4 = S+ MnO 2 +…
Taklif etilgan sxemada qaytaruvchi va oksidlovchini aniqlang.
Redoks reaktsiyalarini yozishni qanday o'rganish kerak? Namuna ma'lum bir algoritmdan foydalanishni nazarda tutadi.

Birinchidan, masalaning shartlariga ko'ra berilgan barcha moddalarda oksidlanish darajalarini belgilash kerak.
Keyinchalik, ushbu jarayonda qaysi moddaning noma'lum mahsulotga aylanishi mumkinligini tahlil qilishingiz kerak. Oksidlovchi (marganets o'z rolini o'ynaydi) va qaytaruvchi (oltingugurt uning roli) mavjud bo'lganligi sababli, kerakli mahsulotdagi oksidlanish darajasi o'zgarmaydi, shuning uchun u suvdir.
Oksidlanish-qaytarilish reaktsiyalarini qanday to'g'ri hal qilishni muhokama qilib, keyingi qadam elektron nisbatni tuzish bo'lishini ta'kidlaymiz:
Mn +7 3 ni oladi e= Mn +4 ;
S -2 2e= S 0 ni beradi.
Marganets kationi qaytaruvchi, oltingugurt anioni esa odatiy oksidlovchi hisoblanadi. Qabul qilingan va berilgan elektronlar orasidagi eng kichik ko'paytma 6 ga teng bo'lgani uchun biz koeffitsientlarni olamiz: 2, 3.
Oxirgi qadam koeffitsientlarni dastlabki tenglamaga kiritish bo'ladi.
3H 2 S+ 2HMnO 4 = 3S+ 2MnO 2 + 4H 2 O.

Yagona davlat imtihonidagi OVR ning ikkinchi namunasi
Oksidlanish-qaytarilish reaktsiyalarini qanday to'g'ri shakllantirish kerak? Yechimlar bilan misollar harakatlar algoritmini ishlab chiqishga yordam beradi.
Reaksiyadagi bo'shliqlarni to'ldirish uchun elektron balans usulidan foydalanish taklif etiladi:
PH 3 + HMnO 4 = MnO 2 +…+…
Biz barcha elementlarning oksidlanish darajalarini tartibga solamiz. Bu jarayonda oksidlovchi xususiyatlar tarkibning bir qismi bo'lgan marganets bilan namoyon bo'ladi va qaytaruvchi vosita fosfor bo'lishi kerak, uning oksidlanish holatini fosfor kislotasida ijobiy holatga o'zgartiradi.
Qabul qilingan taxminga ko'ra, biz reaktsiya sxemasini olamiz, keyin elektron muvozanat tenglamasini tuzamiz.
P -3 8 e ni beradi va P +5 ga aylanadi;
Mn +7 3e ni oladi va Mn +4 ga aylanadi.
LOC 24 bo'ladi, shuning uchun fosforning stereometrik koeffitsienti 3, marganets esa -8 bo'lishi kerak.
Olingan jarayonga koeffitsientlarni qo'yamiz, biz quyidagilarni olamiz:
3 PH 3 + 8 HMnO 4 = 8 MnO 2 + 4H 2 O+ 3 H 3 PO 4.

Yagona davlat imtihonidan uchinchi misol
Elektron-ion balansidan foydalanib, siz reaktsiyani tuzishingiz, qaytaruvchi va oksidlovchi vositani ko'rsatishingiz kerak.
KMnO 4 + MnSO 4 +…= MnO 2 +…+ H2SO 4.
Algoritm bo'yicha biz har bir elementning oksidlanish darajalarini joylashtiramiz. Keyinchalik, jarayonning o'ng va chap qismlarida o'tkazib yuborilgan moddalarni aniqlaymiz. Bu erda qaytaruvchi va oksidlovchi moddalar berilgan, shuning uchun etishmayotgan birikmalarning oksidlanish darajalari o'zgarmaydi. Yo'qotilgan mahsulot suv bo'ladi va boshlang'ich birikma kaliy sulfat bo'ladi. Biz elektron balansni tuzadigan reaktsiya sxemasini olamiz.
Mn +2 -2 e= Mn +4 3 qaytaruvchi;
Mn +7 +3e= Mn +4 2 oksidlovchi.
Jarayonning o'ng tomonidagi marganets atomlarini jamlab, tenglamaga koeffitsientlarni yozamiz, chunki bu nomutanosiblik jarayoni bilan bog'liq.
2KMnO 4 + 3MnSO 4 + 2H 2 O= 5MnO 2 + K 2 SO 4 + 2H 2 SO 4.
Xulosa
Tirik organizmlarning faoliyati uchun oksidlanish-qaytarilish reaksiyalari alohida ahamiyatga ega. OVR ga chirish, fermentatsiya, asabiy faoliyat, nafas olish va metabolizm jarayonlari misol bo'la oladi.
Oksidlanish va qaytarilish metallurgiya va kimyo sanoati uchun dolzarb bo'lib, bunday jarayonlar tufayli metallarni ularning birikmalaridan tiklash, ularni kimyoviy korroziyadan himoya qilish va qayta ishlash mumkin;
Organik moddalarda oksidlanish-qaytarilish jarayonini tuzish uchun ma'lum harakatlar algoritmidan foydalanish kerak. Birinchidan, tavsiya etilgan sxemada oksidlanish darajalari o'rnatiladi, so'ngra indikatorni oshirgan (kamaygan) elementlar aniqlanadi va elektron balans qayd etiladi.
Agar siz yuqorida tavsiya etilgan harakatlar ketma-ketligiga rioya qilsangiz, testlarda taklif qilingan vazifalarni osongina engishingiz mumkin.
Elektron balans usuliga qo'shimcha ravishda, koeffitsientlarni tartibga solish yarim reaktsiyalarni tuzish orqali ham mumkin.