Лекция 4. Радикальная полимеризация.
Радикальная полимеризация протекает по цепному механизму . В результате каждого элементарного акта происходит образование нового радикала, к которому присоединяется новая нейтральная молекула, т.е. кинетическая цепь превращается в материальную . Основные стадии радикальной полимеризации:- инициирование
рост цепи
обрыв цепи
передача цепи
- тепла (термическое инициирование); света (фотоинициирование); ионизирующих излучений (радиационное инициирование); химических инициаторов (химическое инициирование)
Пример .
а) пероксид бензоила
t распада = 70 - 80˚С
Эффективность инициирования f = 0,7 - 0,9
б) азобисизобутиронитрил
t распада = 60 - 75˚С
Эффективность инициирования f = 0,5 - 0,7
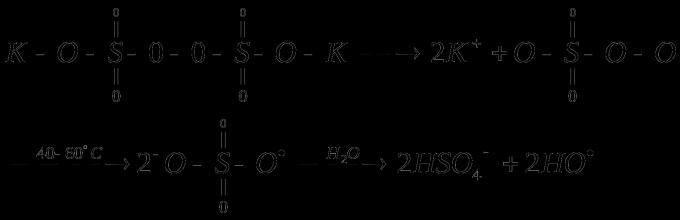
в) персульфат калия
t распад = 40 - 50˚С

Выбор инициатора обусловлен его растворимостью в мономере или растворителе и температурой, при которых может быть достигнута определённая скорость получения свободных радикалов.
Радикал, образующийся при инициировании, присоединяется к двойной (=) связи мономера и начинает реакционную цепь. Поскольку стабильность радикалов, образующихся при распаде пероксидов, азосоединений и других инициаторов разная, скорость их реакции с молекулами мономера, а следовательно, и скорость полимеризации различны. Для облегчения распада инициаторов и снижения энергии активации стадии инициирования в реакцию вводят восстановители (амины, соли металлов переменной степени окисления). С целью понижения  (от 146 до 42 - 84 кДж/моль), облегчения распада инициаторов используют окислительно-восстановительные системы
. Например:
(от 146 до 42 - 84 кДж/моль), облегчения распада инициаторов используют окислительно-восстановительные системы
. Например:
Окислительно-восстановительные системы применяют в водных средах или при полимеризации в эмульсии . Широкое распространение их в промышленности производства полимеров связано с существенным снижением энергии активации распада инициаторов на свободные радикалы и уменьшением таким образом энергетических затрат в производственных условиях. 2. Рост цепи – заключается в последовательном присоединении молекул мономера к образующемуся активному центру с передачей его на конец цепи. Развитие кинетической цепи сопровождением образованием материальной цепи.

(маленькая)
Константа скорости реакции k p = 10 2 – 10 4 (большая)
Энергия активации и константа скорости реакции зависят от природы мономеров, параметров реакционной среды.
3. Обрыв цепи – происходит в результате гибели активных центров.
Обрыв цепи приводит к обрыву материальной и кинетической цепи.
Энергия активации обрыва цепи определяется энергией активации диффузии радикалов. Обрыв может быть при любой длине растущего макрорадикала. При этом получаются макромолекулы разной длины. Обрыв чаще всего происходит двумя способами: путем рекомбинации и диспропорционирования.
Е акт ≤ 4,2 кДж/моль
E акт = 12,6-16,8 кДж/моль
Возможен также обрыв при взаимодействии растущих радикалов с низкомолекулярными веществами, присутствующими в системе. понизив температуру ↓ Понизить скорость обрыва цепи можно повысив вязкость
- Передача цепи
– происходит путём отрыва растущим радикалом атома или группы атомов от какой-то молекулы (передатчика цепи). При этом:
- растущий радикал превращается в валентно - ненасыщенную молекулу; новый радикал развивает кинетическую цепь
 и т. д. Так, теломеризация этилена в среде тетрахлорида углерода протекает с образованием индивидуальных продуктов (тетрахлорпентан, тетрахлоргептан и др.) Пример
. Передача цепи через: а) молекулу мономера б) молекулу растворителя
и т. д. Так, теломеризация этилена в среде тетрахлорида углерода протекает с образованием индивидуальных продуктов (тетрахлорпентан, тетрахлоргептан и др.) Пример
. Передача цепи через: а) молекулу мономера б) молекулу растворителя начало новой цепи
в) специально вводимые вещества (регуляторы), например, меркаптаны.

k m , k s – константы скорости передачи цепи.
При взаимодействии растущего радикала с молекулой передатчика цепи прекращается рост материальной цепи, т.е. снижается молекулярная масса образующегося полимера; кинетическая цепь сохраняется. Способность к участию в передаче цепи при радикальной полимеризации характеризуется константой передачи цепи на мономер C m , на растворитель C s , на инициатор C u .



C m = (0,1 - 5)*10 -4 – маленькое значение
Например, при полимеризации винилацетата C m = 2∙10 - 3 Из растворителей высокое значение C s у  . Так при полимеризации стирола C s = 9∙10 - 3
. Так при полимеризации стирола C s = 9∙10 - 3
Кинетика радикальной полимеризации
Скорость процесса описывается уравнением:  , где
, где  - скорость исчезновения мономера и
- скорость исчезновения мономера и  - скорость инициирования и роста цепи При образовании высокомолекулярного полимера число молекул мономера, участвующих в стадии инициирования намного меньше, чем в стадии роста, поэтому можно пренебречь.
- скорость инициирования и роста цепи При образовании высокомолекулярного полимера число молекул мономера, участвующих в стадии инициирования намного меньше, чем в стадии роста, поэтому можно пренебречь. 
 замерить трудно. Для стационарного процесса скорость возникновения радикала равна скорости их гибели, а скорость изменения концентрации радикалов (
замерить трудно. Для стационарного процесса скорость возникновения радикала равна скорости их гибели, а скорость изменения концентрации радикалов ( )
)  Для стационарного процесса уравнение скорости полимеризации примет вид:
Для стационарного процесса уравнение скорости полимеризации примет вид:  концентрация инициатора (известна и задается до начала реакции) Из уравнения следует, что скорость полимеризации зависит от скорости инициирования в степени 0,5, т.е. увеличение в два раза приводит к увеличению
концентрация инициатора (известна и задается до начала реакции) Из уравнения следует, что скорость полимеризации зависит от скорости инициирования в степени 0,5, т.е. увеличение в два раза приводит к увеличению  в
в  раз. Это объясняется бимолекулярным механизмом отрыва цепи. При термическом инициировании скорость полимеризации V
зависит от соотношения трёх констант скорости реакции
раз. Это объясняется бимолекулярным механизмом отрыва цепи. При термическом инициировании скорость полимеризации V
зависит от соотношения трёх констант скорости реакции  Типичная кинетическая кривая, описывающая конверсию мономера (т.е. превращение мономера в полимер в результате полимеризации) в зависимости от времени, имеет S-образный вид. Р
Типичная кинетическая кривая, описывающая конверсию мономера (т.е. превращение мономера в полимер в результате полимеризации) в зависимости от времени, имеет S-образный вид. Р ис.1 Типичная кинетическая кривая цепной радикальной полимеризации:
ис.1 Типичная кинетическая кривая цепной радикальной полимеризации:
1 – ингибирование; 2 – ускорение полимеризации (скорость растет со временем); 3 – стационарный период (скорость полимеризации постоянная); 4 – замедление полимеризации (скорость уменьшается со временем)
Как видно из рис. 1 на кривой можно выделить пять участков по значениям скоростей основной реакции превращения мономера в полимер в результате полимеризации: 1 – участок ингибирования , где концентрация свободных радикалов мала. И они не могут начать цепной процесс полимеризации; 2 – участок ускорения полимеризации , где начинается основная реакция превращения мономера в полимер, причем скорость растет; 3 – участок стационарного состояния, где происходит полимеризация основного количества мономера при постоянной скорости (прямолинейная зависимость конверсии от времени); 4 – участок замедления реакции , где скорость реакции уменьшается в связи с убылью содержания свободного мономера; 5 – прекращение основной реакции после исчерпания всего количества мономера. Наибольший интерес представляет стационарный период реакции полимеризации, когда при постоянной скорости происходит полимеризация основной массы мономера. Это возможно, когда количество вновь образующихся свободных радикалов (стадия инициирования) равно количеству исчезающих макрорадикалов (стадия обрыва) реакционной и материальной цепей. Степень полимеризации n (т.е. число звеньев мономерных единиц в одной среднестатистической макромолекуле) по определению пропорциональна скорости реакции роста цепи и обратно пропорциональна скорости реакции обрыва цепи, так как нейтральная макромолекула образуется в результате столкновения двух растущих макрорадикалов. n = υ p /υ обр = k p [M] / k обр 2 = k p [M] / k обр = k n / = k n I / [I] 0,5 Иными словами, степень полимеризации и, следовательно, средняя молекулярная масса полимера при свободнорадикальной полимеризации обратно пропорциональна квадратному корню из концентрации инициатора.
Влияние различных факторов на процесс радикальной полимеризации.
1. Влияние температуры С повышением температуры увеличивается скорость реакции образования активных центров и реакции роста цепи. Таким образом, повышается суммарная скорость образования полимера. Обычно скорость полимеризации возрастает в 2-3 раза при повышении температуры на 10 ˚С. Однако при общем увеличении концентрации радикалов увеличивается и вероятность их столкновения друг с другом (обрыв цепи путем диспропорционирования или рекомбинации) или с низкомолекулярными примесями. В результате молекулярная масса полимера в целом уменьшается (средняя степень полимеризации уменьшается с ростом температуры), увеличивается доля низкомолекулярных фракций в полимере. Возрастает число побочных реаций, приводящих к образованию разветвленных молекул. Увеличивается нерегулярность при построении цепи полимера вследствие возрастания доли типов соединения мономера «голова к голове» и «хвост к хвосту». 2. Влияние концентрации инициатора.С повышением концентрации инициатора число свободных радикалов увеличивается, возрастает число активных центров, увеличивается суммарная скорость полимеризации.
Однако при общем увеличении концентрации радикалов увеличивается и вероятность их столкновения друг с другом, т.е. обрыва цепи, что приводит к снижению молекулярной массы полимера. 3. Влияние концентрации мономера.
При полимеризации в среде растворителя суммарная скорость полимеризации и молекулярная масса образующегося полимера увеличивается с повышением концентрации мономера. При полимеризации в инертном растворителе, не участвующем в реакции, скорость полимеризации равна  (часто x = 1,5). Большинство растворителей участвуют в полимеризации (в реакции передачи цепи). Поэтому получаются гораздо более сложные зависимости. 4. Влияние давления.
Давление высокое и сверхвысокое 300-500 МПа (3000-5000 ат) и выше значительно ускоряет полимеризацию. Пример.
Полимеризация метилметакрилата в присутствии
(часто x = 1,5). Большинство растворителей участвуют в полимеризации (в реакции передачи цепи). Поэтому получаются гораздо более сложные зависимости. 4. Влияние давления.
Давление высокое и сверхвысокое 300-500 МПа (3000-5000 ат) и выше значительно ускоряет полимеризацию. Пример.
Полимеризация метилметакрилата в присутствии  воздуха при 100˚C и p = 0,1 МПа продолжается 6 часов, под р = 300 МПа – 1 час, т.е. суммарная скорость полимеризации возрастает примерно в 6 раз. Аналогичным образом влияние p
сказывается на полимеризации стирола, винилацетата, изопрена и др. NB
!
Особенностью полимеризации под p
является то, что увеличение скорости не сопровождается уменьшением молекулярной массы получаемого полимера.
воздуха при 100˚C и p = 0,1 МПа продолжается 6 часов, под р = 300 МПа – 1 час, т.е. суммарная скорость полимеризации возрастает примерно в 6 раз. Аналогичным образом влияние p
сказывается на полимеризации стирола, винилацетата, изопрена и др. NB
!
Особенностью полимеризации под p
является то, что увеличение скорости не сопровождается уменьшением молекулярной массы получаемого полимера.
Ингибиторы и регуляторы полимеризации
Явления обрыва и передачи цепи широко используются на практике для:
- предотвращения преждевременной полимеризации при хранении мономеров;
- для регулирования процесса полимеризации
 ис.2 Термическая полимеризация стирола при 100 ˚С в присутствии ингибиторов и замедлителей: 1 – без добавок; 2- 0,1% бензохинона (ингибитор); 3 – 0,2% нитробензола (ингибитор); 4 – 0,5% нитробензола (замедлитель)
ис.2 Термическая полимеризация стирола при 100 ˚С в присутствии ингибиторов и замедлителей: 1 – без добавок; 2- 0,1% бензохинона (ингибитор); 3 – 0,2% нитробензола (ингибитор); 4 – 0,5% нитробензола (замедлитель)Для регулирования процесса полимеризации применяют ингибиторы и замедлители полимеризации. Ингибиторы
– низкомолекулярные вещества, которые меняют длительность индукционного периода, замедляя его. Это часто необходимо делать в технологии производства полимеров для предотвращения преждевременной полимеризации в неконтролируемых условиях. Ингибиторы: хиноны, ароматические амины, нитросоединения, фенолы, органические соли  ,
,  ,
,  ,
,  и т.д. Пример
: гидрохинон Хинон взаимодействует со свободными радикалами, превращая их в неактивные продукты. Гибель радикалов увеличивает длину индукционного периода. Наряду с ингибиторами, позволяющими полностью остановить полимеризацию, существуют замедлители полимеризации
, которые только уменьшают её скорость. Замедлитель
выполняет двойную роль: снижает концентрацию радикалов и уменьшает время их жизни, что приводит к снижению длины полимерной цепи. Ингибитор не влияет на скорость полимеризации, но предотвращает начало инициирования цепи, увеличивая индукционный период на кинетической кривой полимеризации. Длительность индукционного периода обычно пропорциональна количеству введенного ингибитора. Одно и то же вещество может выступать и как ингибитор, и как замедлитель, и как регулятор полимеризации в зависимости от природы полимеризуемого мономера. Например, кислород, который замедляет полимеризацию винилацетата и ускоряет полимеризацию стирола. При больших давлениях и высоких температурах кислород способствует полимеризации этилена. Это явление используют при промышленном производстве полиэтилена высокого давления. Кислород образует пероксиды или гидропероксиды при взаимодействии с мономерами или растущими цепями. гидропероксид пероксид В зависимости от стабильности промежуточных пероксидов или гидропероксидов они могут либо увеличивать концентрацию радикалов и ускорять полимеризацию, либо дезактивировать имеющиеся радикалы и замедлять или даже ингибировать полимеризацию. Рис.1.3 с.28 кулезнев Пример: ароматические нитро- и нитрозосоединения. Регуляторы полимеризации
вызывают преждевременный обрыв материальной цепи
, снижая молекулярную массу полимера пропорционально введенному количеству регулятора. Примером их являются меркаптаны, в том числе додецилмеркаптан. Из-за большой длины углеводородной цепи его молекулы недостаточно активны и расходуются медленно.
и т.д. Пример
: гидрохинон Хинон взаимодействует со свободными радикалами, превращая их в неактивные продукты. Гибель радикалов увеличивает длину индукционного периода. Наряду с ингибиторами, позволяющими полностью остановить полимеризацию, существуют замедлители полимеризации
, которые только уменьшают её скорость. Замедлитель
выполняет двойную роль: снижает концентрацию радикалов и уменьшает время их жизни, что приводит к снижению длины полимерной цепи. Ингибитор не влияет на скорость полимеризации, но предотвращает начало инициирования цепи, увеличивая индукционный период на кинетической кривой полимеризации. Длительность индукционного периода обычно пропорциональна количеству введенного ингибитора. Одно и то же вещество может выступать и как ингибитор, и как замедлитель, и как регулятор полимеризации в зависимости от природы полимеризуемого мономера. Например, кислород, который замедляет полимеризацию винилацетата и ускоряет полимеризацию стирола. При больших давлениях и высоких температурах кислород способствует полимеризации этилена. Это явление используют при промышленном производстве полиэтилена высокого давления. Кислород образует пероксиды или гидропероксиды при взаимодействии с мономерами или растущими цепями. гидропероксид пероксид В зависимости от стабильности промежуточных пероксидов или гидропероксидов они могут либо увеличивать концентрацию радикалов и ускорять полимеризацию, либо дезактивировать имеющиеся радикалы и замедлять или даже ингибировать полимеризацию. Рис.1.3 с.28 кулезнев Пример: ароматические нитро- и нитрозосоединения. Регуляторы полимеризации
вызывают преждевременный обрыв материальной цепи
, снижая молекулярную массу полимера пропорционально введенному количеству регулятора. Примером их являются меркаптаны, в том числе додецилмеркаптан. Из-за большой длины углеводородной цепи его молекулы недостаточно активны и расходуются медленно.

 ,
,  .
. Способы проведения полимеризации
Радикальную полимеризацию проводят в блоке (массе), растворе, эмульсии, суспензии и газовой фазе. При этом процесс может протекать в гомогенных или гетерогенных условиях. Кроме того, фазовое состояние исходной реакционной смеси может также меняться в ходе полимеризации.
Полимеризация в блоке (в массе )
Полимеризация в растворе
В отличие от полимеризации в блоке в данном случае отсутствуют местные перегревы, так как тепло реакции снимается растворителем, выполняющим также роль разбавителя. Уменьшается вязкость реакционной системы, что облегчает её перемешивание.
Однако возрастает роль (доля) реакций передачи цепи, что приводит к понижению молекулярной массы полимера. Кроме того, полимер может быть загрязнён остатками растворителя, который не всегда удаётся удалить из полимера. Существует два способа проведения полимеризации в растворе. а) Применяют растворитель, в котором растворяется и мономер, и полимер. Получаемый полимер используют непосредственно в растворе или выделяют его осаждением или испарением растворителя. б) В растворителе, используемом для полимеризации, растворяется мономер, но не растворяется полимер. Полимер по мере образования выпадает в твердом виде и может быть отделен фильтрованием.
Полимеризация в суспензии (бисерная или гранульная)
 в виде мелких капель. Устойчивость дисперсии достигается механическим перемешиванием и введением в реакционную систему специальных добавок – стабилизаторов. Процесс полимеризации осуществляют в каплях мономера, которые можно рассматривать как микрореакторы блочной полимеризации. Применяют инициаторы, растворимые в мономере. Достоинством этого процесса является хороший отвод тепла, недостатком - возможность загрязнения полимера остатками стабилизатора
в виде мелких капель. Устойчивость дисперсии достигается механическим перемешиванием и введением в реакционную систему специальных добавок – стабилизаторов. Процесс полимеризации осуществляют в каплях мономера, которые можно рассматривать как микрореакторы блочной полимеризации. Применяют инициаторы, растворимые в мономере. Достоинством этого процесса является хороший отвод тепла, недостатком - возможность загрязнения полимера остатками стабилизатора Полимеризация в эмульсии (эмульсионная полимеризация)
Газофазная полимеризация
- Свободнорадикальная полимеризация – один из видов цепных процессов синтеза полимеров. Поляризация исходных молекул мономера облегчает их реакции с радикалами инициатора при химическом инициировании или при физических методах генерации радикалов. Электроноакцепторные заместители способствуют большей стабильности радикалов мономера и растущих цепей. Процесс радикальной полимеризации можно регулировать различными приемами как по скорости конверсии мономера, так и по величине молекулярной массы полимера. Для этого используют добавки низкомолекулярных веществ, выполняющих функции ингибиторов или замедлителей реакции, а также осуществляющих передачу реакционной цепи или снижающих энергию активации распада инициаторов на радикалы. Знание закономерностей свободнорадикальной полимеризации позволяет управлять структурой полимера, а следовательно, и его физическими и механическими свойствами. Благодаря простоте этот способ получения полимеров нашел широкое применение в промышленности.
Лекция 4. Радикальная полимеризация.
Радикальная полимеризация протекает по цепному механизму .
В результате каждого элементарного акта происходит образование нового радикала, к которому присоединяется новая нейтральная молекула, т.е. кинетическая цепь превращается в материальную .
Основные стадии радикальной полимеризации:
– инициирование
– рост цепи
– обрыв цепи
– передача цепи
1 . Инициирование заключается в образовании свободных радикалов под действием:
– тепла (термическое инициирование);
– света (фотоинициирование);
– ионизирующих излучений (радиационное инициирование);
– химических инициаторов (химическое инициирование)
Первые три способа малоэффективны, т.к. сопровождаются различными побочными реакциями (разветвление, деструкция и т.д.). Чаще всего используют химическое инициирование, при котором образование свободных радикалов происходит вследствие термического и фотохимического распада различных соединений, содержащих нестабильные (лабильные) связи, а также в результате ОВР. Наиболее распространёнными инициаторами являются: пероксиды, гидропероксиды, изо- и диазосоединения, перэфиры, ацилпероксиды.
Пример .
а) пероксид бензоила
t распада = 70 - 80˚С
Эффективность инициирования f = 0,7 - 0,9
б) азобисизобутиронитрил
t распада = 60 - 75˚С
Эффективность инициирования f = 0,5 - 0,7
в) персульфат калия
t распад = 40 - 50˚С

Выбор инициатора обусловлен его растворимостью в мономере или растворителе и температурой, при которых может быть достигнута определённая скорость получения свободных радикалов.
Радикал, образующийся при инициировании, присоединяется к двойной (=) связи мономера и начинает реакционную цепь.
Поскольку стабильность радикалов, образующихся при распаде пероксидов, азосоединений и других инициаторов разная, скорость их реакции с молекулами мономера, а следовательно, и скорость полимеризации различны. Для облегчения распада инициаторов и снижения энергии активации стадии инициирования в реакцию вводят восстановители (амины, соли металлов переменной степени окисления).
С целью понижения (от 146 до 42 - 84 кДж/моль), облегчения распада инициаторов используют окислительно-восстановительные системы .
Например:
https://pandia.ru/text/80/211/images/image008_31.gif" width="231" height="104 src=">
Окислительно-восстановительные системы применяют в водных средах или при полимеризации в эмульсии . Широкое распространение их в промышленности производства полимеров связано с существенным снижением энергии активации распада инициаторов на свободные радикалы и уменьшением таким образом энергетических затрат в производственных условиях.
2. Рост цепи – заключается в последовательном присоединении молекул мономера к образующемуся активному центру с передачей его на конец цепи.
Развитие кинетической цепи сопровождением образованием материальной цепи.

(маленькая)
Константа скорости реакции kp = 102 – 104 (большая)
Энергия активации и константа скорости реакции зависят от природы мономеров, параметров реакционной среды.
3. Обрыв цепи – происходит в результате гибели активных центров.
Обрыв цепи приводит к обрыву материальной и кинетической цепи.
Энергия активации обрыва цепи определяется энергией активации диффузии радикалов.
Обрыв может быть при любой длине растущего макрорадикала. При этом получаются макромолекулы разной длины.
Обрыв чаще всего происходит двумя способами: путем рекомбинации и диспропорционирования .
Еакт ≤ 4,2 кДж/моль
Eакт = 12,6-16,8 кДж/моль
Возможен также обрыв при взаимодействии растущих радикалов с низкомолекулярными веществами, присутствующими в системе.
Понизив температуру ↓
Понизить скорость обрыва цепи можно
повысив вязкость
4. Передача цепи – происходит путём отрыва растущим радикалом атома или группы атомов от какой-то молекулы (передатчика цепи). При этом:
– растущий радикал превращается в валентно - ненасыщенную молекулу;
– новый радикал развивает кинетическую цепь
Таким образом, реакция передачи цепи заключается в том, что вводимое в систему вещество – регулятор- обрывает растущую цепь, но при этом само становится свободным радикалом и начинает новую кинетическую цепь полимеризации.
Повышение температуры и увеличение количества агента передачи цепи (например, галогенсодержащих углеводородов) приводят к резкому возрастанию скорости реакции передачи цепи. Эта реакция подавляет другие стадии полимеризации, так, что образуются индивидуальные низкомолекулярные вещества, которые можно разделить(реакция теломеризации). Они содержат концевые группы из продуктов расщепления агента передачи цепи и являются активными в различных химических реакциях, в частности для получения новых полимеров.
Теломеры: олигомеры, имеющие на концах молекул реакционноспособные группы.
 и т. д.
и т. д.
Так, теломеризация этилена в среде тетрахлорида углерода протекает с образованием индивидуальных продуктов (тетрахлорпентан, тетрахлоргептан и др.)
Пример . Передача цепи через:
а) молекулу мономера
б) молекулу растворителя
начало новой цепи
в) специально вводимые вещества (регуляторы), например, меркаптаны.

km , ks – константы скорости передачи цепи.
При взаимодействии растущего радикала с молекулой передатчика цепи прекращается рост материальной цепи, т.е. снижается молекулярная масса образующегося полимера; кинетическая цепь сохраняется.
Способность к участию в передаче цепи при радикальной полимеризации характеризуется константой передачи цепи на мономер Cm , на растворитель Cs, на инициатор Cu.
Cm = (0,1 - 5)*10-4 – маленькое значение
Например, при полимеризации винилацетата Cm = 2∙10-3
Из растворителей высокое значение Cs у . Так при полимеризации стирола Cs = 9∙10-3
Кинетика радикальной полимеризации
Скорость процесса описывается уравнением: https://pandia.ru/text/80/211/images/image026_11.gif" width="44" height="41"> - скорость исчезновения мономера
И - скорость инициирования и роста цепи
При образовании высокомолекулярного полимера число молекул мономера, участвующих в стадии инициирования намного меньше, чем в стадии роста, поэтому можно пренебречь.
![]()
Замерить трудно. Для стационарного процесса скорость возникновения радикала равна скорости их гибели, а скорость изменения концентрации радикалов ()
Для стационарного процесса уравнение скорости полимеризации примет вид:

концентрация инициатора (известна и задается до начала реакции)
Из уравнения следует, что скорость полимеризации зависит от скорости инициирования в степени 0,5, т.е..gif" width="49" height="25"> в раз. Это объясняется бимолекулярным механизмом отрыва цепи.
При термическом инициировании скорость полимеризации V зависит от соотношения трёх констант скорости реакции
Типичная кинетическая кривая, описывающая конверсию мономера (т.е. превращение мономера в полимер в результате полимеризации) в зависимости от времени, имеет S-образный вид.
 Рис.1 Типичная кинетическая кривая цепной радикальной полимеризации:
Рис.1 Типичная кинетическая кривая цепной радикальной полимеризации:
1 – ингибирование; 2 – ускорение полимеризации (скорость растет со временем); 3 – стационарный период (скорость полимеризации постоянная); 4 – замедление полимеризации (скорость уменьшается со временем)
Как видно из рис. 1 на кривой можно выделить пять участков по значениям скоростей основной реакции превращения мономера в полимер в результате полимеризации: 1 – участок ингибирования , где концентрация свободных радикалов мала. И они не могут начать цепной процесс полимеризации; 2 – участок ускорения полимеризации , где начинается основная реакция превращения мономера в полимер, причем скорость растет; 3 – участок стационарного состояния, где происходит полимеризация основного количества мономера при постоянной скорости (прямолинейная зависимость конверсии от времени); 4 – участок замедления реакции , где скорость реакции уменьшается в связи с убылью содержания свободного мономера; 5 – прекращение основной реакции после исчерпания всего количества мономера.
Наибольший интерес представляет стационарный период реакции полимеризации, когда при постоянной скорости происходит полимеризация основной массы мономера. Это возможно, когда количество вновь образующихся свободных радикалов (стадия инициирования) равно количеству исчезающих макрорадикалов (стадия обрыва) реакционной и материальной цепей.
Степень полимеризации n (т.е. число звеньев мономерных единиц в одной среднестатистической макромолекуле) по определению пропорциональна скорости реакции роста цепи и обратно пропорциональна скорости реакции обрыва цепи, так как нейтральная макромолекула образуется в результате столкновения двух растущих макрорадикалов.
n = υp /υобр = kp[M] / kобр2 = kp[M] / kобр = kn / = knI / [I]0,5
Иными словами, степень полимеризации и, следовательно, средняя молекулярная масса полимера при свободнорадикальной полимеризации обратно пропорциональна квадратному корню из концентрации инициатора.
Влияние различных факторов на процесс радикальной полимеризации.
1. Влияние температуры
С повышением температуры увеличивается скорость реакции образования активных центров и реакции роста цепи. Таким образом, повышается суммарная скорость образования полимера. Обычно скорость полимеризации возрастает в 2-3 раза при повышении температуры на 10 ˚С. Однако при общем увеличении концентрации радикалов увеличивается и вероятность их столкновения друг с другом (обрыв цепи путем диспропорционирования или рекомбинации) или с низкомолекулярными примесями. В результате молекулярная масса полимера в целом уменьшается (средняя степень полимеризации уменьшается с ростом температуры), увеличивается доля низкомолекулярных фракций в полимере. Возрастает число побочных реаций, приводящих к образованию разветвленных молекул. Увеличивается нерегулярность при построении цепи полимера вследствие возрастания доли типов соединения мономера «голова к голове» и «хвост к хвосту».
2. Влияние концентрации инициатора.
С повышением концентрации инициатора число свободных радикалов увеличивается, возрастает число активных центров, увеличивается суммарная скорость полимеризации.
Однако при общем увеличении концентрации радикалов увеличивается и вероятность их столкновения друг с другом, т.е. обрыва цепи, что приводит к снижению молекулярной массы полимера.
3. Влияние концентрации мономера.
При полимеризации в среде растворителя суммарная скорость полимеризации и молекулярная масса образующегося полимера увеличивается с повышением концентрации мономера.
При полимеризации в инертном растворителе, не участвующем в реакции, скорость полимеризации равна (часто x = 1,5).
Большинство растворителей участвуют в полимеризации (в реакции передачи цепи). Поэтому получаются гораздо более сложные зависимости.
4. Влияние давления.
Давление высокое и сверхвысокое 300-500 МПа (3000-5000 ат) и выше значительно ускоряет полимеризацию.
Пример. Полимеризация метилметакрилата в присутствии https://pandia.ru/text/80/211/images/image041_1.jpg" align="left" width="217" height="161">Рис.2 Термическая полимеризация стирола при 100 ˚С в присутствии ингибиторов и замедлителей:
1 – без добавок; 2- 0,1% бензохинона (ингибитор); 3 – 0,2% нитробензола (ингибитор); 4 – 0,5% нитробензола (замедлитель)
Для регулирования процесса полимеризации применяют ингибиторы и замедлители полимеризации. Ингибиторы – низкомолекулярные вещества, которые меняют длительность индукционного периода, замедляя его. Это часто необходимо делать в технологии производства полимеров для предотвращения преждевременной полимеризации в неконтролируемых условиях.
Ингибиторы: хиноны, ароматические амины, нитросоединения, фенолы, органические соли , , , и т.д.
Пример : гидрохинон

Хинон взаимодействует со свободными радикалами, превращая их в неактивные продукты. Гибель радикалов увеличивает длину индукционного периода.
Наряду с ингибиторами, позволяющими полностью остановить полимеризацию, существуют замедлители полимеризации , которые только уменьшают её скорость. Замедлитель выполняет двойную роль: снижает концентрацию радикалов и уменьшает время их жизни, что приводит к снижению длины полимерной цепи.
Ингибитор не влияет на скорость полимеризации, но предотвращает начало инициирования цепи, увеличивая индукционный период на кинетической кривой полимеризации. Длительность индукционного периода обычно пропорциональна количеству введенного ингибитора. Одно и то же вещество может выступать и как ингибитор, и как замедлитель, и как регулятор полимеризации в зависимости от природы полимеризуемого мономера. Например, кислород, который замедляет полимеризацию винилацетата и ускоряет полимеризацию стирола. При больших давлениях и высоких температурах кислород способствует полимеризации этилена. Это явление используют при промышленном производстве полиэтилена высокого давления. Кислород образует пероксиды или гидропероксиды при взаимодействии с мономерами или растущими цепями.
гидропероксид
пероксид
В зависимости от стабильности промежуточных пероксидов или гидропероксидов они могут либо увеличивать концентрацию радикалов и ускорять полимеризацию, либо дезактивировать имеющиеся радикалы и замедлять или даже ингибировать полимеризацию. Рис.1.3 с.28 кулезнев
Пример: ароматические нитро- и нитрозосоединения.
Регуляторы полимеризации вызывают преждевременный обрыв материальной цепи , снижая молекулярную массу полимера пропорционально введенному количеству регулятора. Примером их являются меркаптаны, в том числе додецилмеркаптан. Из-за большой длины углеводородной цепи его молекулы недостаточно активны и расходуются медленно.

Примеси в мономере и растворителе : степень их влияния на процесс полимеризации определяется их химической природой и реакционной способностью по отношению к активным частицам.
Для исключения влияния этих факторов берут для синтеза мономеры и растворители «кинетической чистоты», иногда вместо https://pandia.ru/text/80/211/images/image050_4.gif" width="23" height="17">, .
Способы проведения полимеризации
Радикальную полимеризацию проводят в блоке (массе), растворе, эмульсии, суспензии и газовой фазе. При этом процесс может протекать в гомогенных или гетерогенных условиях. Кроме того, фазовое состояние исходной реакционной смеси может также меняться в ходе полимеризации.
1. Полимеризация в блоке (в массе )
Полимеризацию проводят без растворителя. Из-за высокой экзотермичности процесс полимеризации трудно поддаётся регулированию. В ходе реакции повышается вязкость и затрудняется отвод тепла, вследствие чего возникают местные перегревы, приводящие к деструкции полимера, неоднородности его по молекулярной массе. Достоинством полимеризации в массе является возможность получения полимера в форме сосуда, в котором проводится процесс без какой-либо дополнительной обработки.
2. Полимеризация в растворе
В отличие от полимеризации в блоке в данном случае отсутствуют местные перегревы, так как тепло реакции снимается растворителем, выполняющим также роль разбавителя. Уменьшается вязкость реакционной системы, что облегчает её перемешивание.
Однако возрастает роль (доля) реакций передачи цепи, что приводит к понижению молекулярной массы полимера. Кроме того, полимер может быть загрязнён остатками растворителя, который не всегда удаётся удалить из полимера.
Существует два способа проведения полимеризации в растворе.
а) Применяют растворитель, в котором растворяется и мономер, и полимер. Получаемый полимер используют непосредственно в растворе или выделяют его осаждением или испарением растворителя.
б) В растворителе, используемом для полимеризации, растворяется мономер, но не растворяется полимер. Полимер по мере образования выпадает в твердом виде и может быть отделен фильтрованием.
3. Полимеризация в суспензии (бисерная или гранульная)
Широко используется для синтеза полимеров. При этом мономер диспергируют в Дисперсия" href="/text/category/dispersiya/" rel="bookmark">дисперсии достигается механическим перемешиванием и введением в реакционную систему специальных добавок – стабилизаторов. Процесс полимеризации осуществляют в каплях мономера, которые можно рассматривать как микрореакторы блочной полимеризации. Применяют инициаторы, растворимые в мономере.
Достоинством этого процесса является хороший отвод тепла, недостатком - возможность загрязнения полимера остатками стабилизатора
4. Полимеризация в эмульсии (эмульсионная полимеризация)
При эмульсионной полимеризации дисперсионной средой является вода. В качестве эмульгаторов используют различные мыла. Для инициирования чаще всего применяют водорастворимые инициаторы, окислительно - восстановительные системы.
Полимеризация может протекать в молекулярном растворе мономера в , на поверхности раздела капля мономера - , на поверхности или внутри мицелл мыла, на поверхности или внутри образующихся полимерных частиц, набухших в полимере.
Достоинствами процесса являются: высокая скорость, образование полимера большой молекулярной массы, лёгкость отвода тепла. Однако в результате эмульсионной полимеризации образуется большое количество сточных вод, требующих специальной очистки. Также необходимо удаление остатков эмульгатора из полимера.
5. Газофазная полимеризация
При газофазной полимеризации мономер (например, этилен) находится в газообразном состоянии. В качестве инициаторов могут использоваться и пероксиды. Процесс протекает при высоком p .
Выводы:
Свободнорадикальная полимеризация – один из видов цепных процессов синтеза полимеров. Поляризация исходных молекул мономера облегчает их реакции с радикалами инициатора при химическом инициировании или при физических методах генерации радикалов. Электроноакцепторные заместители способствуют большей стабильности радикалов мономера и растущих цепей. Процесс радикальной полимеризации можно регулировать различными приемами как по скорости конверсии мономера, так и по величине молекулярной массы полимера. Для этого используют добавки низкомолекулярных веществ, выполняющих функции ингибиторов или замедлителей реакции, а также осуществляющих передачу реакционной цепи или снижающих энергию активации распада инициаторов на радикалы. Знание закономерностей свободнорадикальной полимеризации позволяет управлять структурой полимера, а следовательно, и его физическими и механическими свойствами. Благодаря простоте этот способ получения полимеров нашел широкое применение в промышленности.
Радикальная полимеризация, как правило, представляет собой разновидность цепных реакций. Такие реакции протекают под влиянием свободных радикалов, образующихся в начале процесса и реагирующих далее с нейтральными молекулами с образованием новых реакционноспособных радикалов.
Цепная полимеризация может инициироваться методами, известными для газофазных цепных реакций, в том числе ультрафиолетовым излучением. Один акт инициирования цепной полимеризации ведет к соединению друг с другом тысяч мономерных молекул. Другими признаками радикального цепного характера реакции полимеризации являются влияние примесей и формы реакционного сосуда на ее скорость, специфический s-образный вид кинетической кривой (зависимость степени превращения мономера в полимер от времени, рис. 5).
|
|
Рис. 5. Типичная кинетическая s-образная кривая полимеризации
Радикальная полимеризация имеет три характерные для цепных реакций стадии: инициирование, рост и обрыв цепи.
Для инициирования
реакции необходимо, чтобы в системе осуществилось получение (генерирование) свободных радикалов в результате теплового воздействия (термическое инициирование),
светового (фотоинициирование),
радиоактивного облучения (радиационное инициирование),
введение химических инициаторов (химическое радикальное инициирование)
и др. Термическое инициирование применяется редко, так как связано с большими затратами энергии, и при этом плохо поддаются регулированию как сам процесс реакции, так и свойства готового полимера. Фотоинициирование применяется главным образом для изучения механизма реакций полимеризации. Оно состоит в возбуждении молекулы мономера в результате поглощения кванта света и в генерировании затем свободных радикалов. В отличие от термической полимеризации скорость фотополимеризации не зависит от температуры, так как энергия активации ее значительно ниже. Скорость растет с увеличением интенсивности облучения. В этом случае подтверждением цепного характера реакции является протекание полимеризации после удаления источника света (рис. 6).

Рис. 6. Скорость полимеризации бутадиена: 1 - при освещении, 2 – после прекращения освещения
Радиационная полимеризация в принципе аналогична фотополимеризации. Скорость ее также растет с увеличением интенсивности облучения и не зависит от температуры. Скорость радиационной и фотополимеризации может быть увеличена добавлением веществ, которые легко распадаются под действием радиационного излучения или света (так называемые сенсибилизаторы полимеризации), например полигалогениды - CCl4, C2Cl6 и др.
Термический, фото - и радиационный способы инициирования цепной реакции полимеризации либо мало эффективны, либо сопровождаются протеканием различных побочных явлений (разветвление, деструкция цепей и т. д.). Поэтому на практике чаще всего применяется химическое инициирование, которое осуществляется специально вводимыми в систему легко распадающимися на радикалы веществами - инициаторами. Наиболее распространены среди них перекиси, азо - и диазосоединения. Распад этих соединений на радикалы может быть осуществлен различными путями, включая нагревание, фотохимическое разложение и др. Например, при легком нагревании перекись бензоила распадается по схеме
а гидроперекись изопропиленбензола так:

Динитрил азоизомасляной кислоты (азо-бис-изобутиронитрил) распадается с выделением азота:
Свободные радикалы (R·) легко реагируют с молекулой мономера:
|
|
которая становится свободным радикалом и реагирует со следующей молекулой мономера, и таким образом осуществляется реакция роста цепи. Поскольку стабильность радикалов, образующихся при распаде перекисей, азосоединений и других инициаторов, разная, то и скорость их реакции с молекулами мономера, а следовательно, и скорость полимеризации различны. Для облегчения распада инициаторов и снижения энергии активации стадии инициирования в реакцию вводят восстановители (амины и другие соединения, соли металлов переменной валентности).
Стадия роста цепи требует значительно меньшей энергии активации - 25,1-33,5 кДж/моль (6-8 ккал/моль), чем стадия инициирования - 84-126 кДж/моль (20-30 ккал/моль), и представляет взаимодействие растущих свободных радикалов с молекулами мономера, что приводит в итоге к образованию макромолекулы полимера:
Нейтральная макромолекула образуется на стадии обрыва цепи, энергия активации которой 8-17 кДж/моль (2-4 ккал/моль):

Такой обрыв цепи происходит в результате столкновения двух растущих макрорадикалов (рекомбинация). Возможно также диспропорционирование таких радикалов с образованием двух нейтральных молекул:

Причиной обрыва цепи может быть также присоединение к макрорадикалу низкомолекулярных веществ, присутствующих в системе (инициаторы, ингибиторы и др.). Время жизни растущих радикалов мало (обычно несколько секунд). По мере роста радикалов увеличивается вязкость системы, и вследствие уменьшения подвижности макрорадикалов скорость обрыва цепи путем рекомбинации снижается. Время жизни радикалов возрастает также при снижении температуры. Рост времени жизни макрорадикалов при увеличении вязкости системы приводит к интересному явлению - ускорению полимеризации на поздних стадиях (гель-эффект) вследствие увеличения концентрации макрорадикалов.
Как можно видеть из приведенных схем реакций роста и обрыва цепи, образуются макромолекулы полимера разной молекулярной массы. Широкий разброс значений молекулярной массы для образца полимера обычно приводит к ухудшению его механических свойств. Поэтому при получении полимера стремятся регулировать его молекулярную массу, что можно осуществить путем направленного изменения скорости роста цепи.
Для этой цели пользуются реакцией передачи цепи, которая заключается в том, что вводимое в систему вещество - регулятор - обрывает растущую цепь, но при этом само становится свободным радикалом и начинает новую кинетическую цепь реакции полимеризации. Таким образом, в данном случае обрывается материальная цепь, а кинетическая продолжается, в то время как в обычной реакции обрыва происходит обрыв как кинетической, так и материальной цепи. Роль агентов передачи цепи могут выполнять растворитель (особенно активны галогенсодержащие соединения, например СС14), мономер или специально вводимые вещества (регуляторы), например меркаптаны.
(обрыв цепи)
(начало новой цепи)
 или
или
Во всех случаях происходит рост новой макромолекулы полимера на каждый акт передачи цепи. Передача цепи может произойти также на молекулу полимера. В этом случае образуется разветвленная макромолекула. Повышение температуры и увеличение количества агента передачи цепи (например, галогенсодержащих углеводородов) приводят к резкому возрастанию скорости реакции передачи цепи, и эта реакция подавляет другие стадии полимеризации, так что образуются индивидуальные низкомолекулярные вещества, которые можно разделить (реакция теломеризации). Они содержат концевые группы из продуктов расщепления агента передачи цепи и являются активными в различных химических реакциях, в частности при получении новых полимеров.
Низкомолекулярные вещества, которые в результате реакции с радикалами мономеров предотвращают рост макромолекул или замедляют его, называются ингибиторами
или замедлителями.
Они широко используются для предотвращения преждевременной полимеризации или снижения ее скорости, для получения полимеров желательной молекулярной массы и более регулярной структуры. Такими веществами являются бензохинон, нитробензол и др. (рис. 7).

Рис. 7. Термическая полимеризация стирола при 100°С в присутствии ингибиторов и замедлителей:
1 - без добавок; 2- 0,1% бензохинона (ингибитор); 3 - 0,2% нитробензола (ингибитор); 4- 0,5% нитробензола (замедлитель)
Замедлитель выполняет двоякую роль: уменьшает концентрацию радикалов и время их жизни, что приводит к снижению длины полимерной цепи. Ингибитор не влияет на скорость полимеризации, но предотвращает начало инициирования цепи, увеличивая индукционный период на кинетической кривой полимеризации. Величина индукционного периода обычно пропорциональна количеству введенного ингибитора. Одно и то же вещество может выступать и как ингибитор, и как замедлитель, и как регулятор полимеризации - в зависимости от природы полимеризуемого мономера. В этом отношении особенно интересен кислород, который, например, замедляет полимеризацию винилацетата и ускоряет полимеризацию стирола. При больших давлениях и высоких температурах кислород способствует полимеризации этилена, что используется в промышленном производстве полиэтилена высокого давления. Кислород образует перекиси или гидроперекиси при взаимодействии с мономерами или растущими цепями. В зависимости от стабильности эти промежуточные перекиси или гидроперекиси могут либо увеличивать концентрацию радикалов и ускорять полимеризацию, либо дезактивировать имеющиеся радикалы и замедлять или даже ингибировать полимеризацию.
Рассмотрение кинетических закономерностей радикальной полимеризации дало возможность сделать ряд важных в практическом и теоретическом отношении выводов о влиянии различных факторов на этот процесс. Установлено, что скорость инициирования пропорциональна концентрации инициатора, а общая скорость полимеризации в стационарном периоде (когда скорость инициирования равна скорости обрыва цепи и, следовательно, общая скорость равна скорости роста цепи) пропорциональна квадратному корню из концентрации инициатора и первой степени концентрации мoномера u = K[M]1/2. Что касается степени полимеризации, т. е. молекулярной массы, то она обратно пропорциональна квадратному корню из концентрации инициатора n = K`[M]/1/2. Физический смысл этого положения заключается в том, что с ростом концентрации инициатора растет и число радикалов, образующихся в системе. Эти радикалы реагируют с большим числом молекул мономера и тем увеличивают скорость их превращения в растущие макрорадикалы. Однако при общем увеличении концентрации радикалов повышается и вероятность их столкновения друг с другом, т. е. обрыва цепи полимеризации. Это приводит к снижению средней молекулярной массы полимера.
Аналогичным образом можно рассмотреть влияние температуры на кинетику радикальной полимеризации. Обычно скорость полимеризации возрастает в 2-3 раза при повышении температуры на 10°. Повышение температуры увеличивает скорость инициирования полимеризации, так как облегчает распад на радикалы инициаторов и их реакцию с молекулами мономера. Вследствие большей подвижности малых радикалов с повышением температуры увеличивается вероятность их столкновения друг с другом (обрыв цепи путем диспропорционирования или рекомбинации) или с низкомолекулярными примесями (ингибиторами). Во всех случаях молекулярная масса полимера снижается, т. е. средняя степень полимеризации уменьшается с ростом температуры. Таким образом повышается количество низкомолекулярных фракций полимера в общем балансе распределения макромолекул по их молекулярным массам, возрастает доля побочных реакций, приводящих к образованию разветвленных молекул, появляется химическая нерегулярность построения цепи полимера вследствие увеличения доли типов соединения мономера «голова к голове» и «хвост к хвосту».
В реакцию полимеризации вступают соединения, которые содержат по крайней мере одну кратную связь или циклы. Реакционная способность мономера зависит от его строения, сопряжения двойной связи в молекуле мономера, количества и взаимного расположения заместителей, их поляризационного явления на двойную связь.
Радикальная полимеризация протекает по цепному механизму и описывается кинетикой неразветвленной цепной реакции.
Основные стадии цепной реакции:
- Инициирование - образование активных центров;
- Рост цепи - последовательное присоединение мономеров к активному центру;
- Обрыв цепи - гибель активного центра;
- Передача цепи - передача активного центра на другую молекулу.
I. Инициирование цепи (зарождение)
Данная стадия является самой энергоемкой. Различают физическое и химическое инициирование.
Физическое инициирование:
Химическое инициирование
Данный способ инициирования применяется чаще всего. Принцип заключается в использовании веществ-инициаторов (перекиси, азосоединения, red-ox системы), у которых энергия обрыва химической связи значительно меньше, чем у мономеров. При этом процесс происходит в две стадии: сначала генерируются радикалы инициатора, которые затем присоединяются к молекуле мономера, образуя первичный мономерный радикал.


Инициатор очень похож по свойствам на катализатор, но его отличие состоит в том, что инициатор расходуется в процессе химической реакции, а катализатор - нет.
Примеры инициаторов:

II. Рост Цепи
Мономеры поочередно присоединяются к активному центру первичного мономерного радикала.

III. Обрыв цепи
Обрыв цепи происходит в результате гибели активных центров (обрыв кинетической цепи).
- Обрыв кинетической цепи - исчезают активные центры;
- Обрыв материальной цепи - когда данная цепь перестает расти, но активный центр передается другой макромолекуле или мономеру (реакция передачи цепи).
Реакции приводящие к гибели кинетической и материальной цепи – реакции рекомбинации
и диспропорционирования.

Вид реакции обрыва цепи (рекомбинация или диспропорционирование) зависит от ряда факторов, в частности от строения молекулы мономера. Если мономер содержит громоздкий по размеру или электроотрицательный по химической природе заместитель, то столкновения таких растущих радикалов друг с другом не происходит и обрыв цепи осуществляется путем диспропорционирования. Например, в случае метилметакрилата:

По мере роста радикалов увеличивается вязкость системы, и вследствие подвижности макрорадикалов скорость обрыва цепи путем рекомбинации снижается. Рост времени жизни макрорадикалов при увеличении вязкости системы приводит к интересному явлению – ускорению полимеризации на поздних стадиях (гель-эффект ) вследствие увеличения концентрации макрорадикалов.
IV. Передача цепи
Передача цепи происходит путём отрыва растущим радикалом атома или группы атомов от какой-то молекулы. Реакция передача цепи приводит к обрыву материальной цепи, а рост кинетической продолжается.
Различают передачу цепи:

Особенности радикальной полимеризации:
- Высокая скорость полимеризации;
- Разветвленность;
- Возможны присоединения г-г, г-хв, хв-хв;
- Полимолекулярные полимеры.
Кинетика радикальной полимеризации
Химическая кинетика - это раздел химии, изучающий механизм и закономерности протекания химической реакции во времени, зависимости этих закономерностей от внешних условий.
Для изучения кинетики радикальной полимеризации необходимо рассмотреть зависимость скорости реакции и степени полимеризации от концентрации исходных веществ, давления и температуры.
Обозначения:

I. Влияние концентрации исходных веществ на скорость реакции.
Общая скорость реакции зависит от скорости образования радикалов V ин (скорости инициирования) , от скорости роста цепи V р и ее обрыва V o.

Мы будем рассматривать реакцию свободнорадикальной полимеризации, когда инициирование осуществляется с помощью химических инициаторов.
Рассмотрим каждую стадию:

Рассмотрение кинетики существенно облегчается, если реакция протекает в условиях, близких к стационарному режиму , при котором скорости возникновения и исчезновения свободных радикалов можно считать равными . При этом концентрация активных центров будет постоянна.

Как видно из графика кривой можно выделить пять участков по значениям скоростей основной реакции превращения мономера в полимер в результате полимеризации:
1 - участок ингибирования, где концентрация свободных радикалов мала. И они не могут начать цепной процесс полимеризации;
2 - участок ускорения полимеризации, где начинается основная реакция превращения мономера в полимер, причем скорость растет;
3 - участок стационарного состояния , где происходит полимеризация основного количества мономера при постоянной скорости (прямолинейная зависимость конверсии от времени);
4 - участок замедления реакции, где скорость реакции уменьшается в связи с убылью содержания свободного мономера;
5 - прекращение основной реакции после исчерпания всего количества мономера.Стационарный режим наблюдается обычно на начальной стадии протекания реакции, когда вязкость реакционной массы невелика и равновероятны случаи зарождения цепи и ее обрыва.

Таким образом скорость реакции роста цепи равна:

II. Влияние концентрации исходных веществ на степень полимеризации.
Степень полимеризации зависит от соотношения скоростей роста и обрыва цепи:

Учтем соответствующие выражения для скоростей

Степень полимеризации равна:

III. Влияние температуры на скорость реакции роста цепи.


Выполним подстановку уравнения Аррениуса в уравнение скорости роста цепи:
Прологарифмируем полученное выражение:
Числитель (6+15-4 = 17) больше нуля, значит, чем больше температура, тем выше скорость реакции радикальной полимеризации. Однако с ростом температуры увеличивается и вероятность столкновения радикалов друг с другом (обрыв цепи путем диспропорционирования или рекомбинации) или с низкомолекулярными примесями. В результате молекулярная масса полимера в целом уменьшается, увеличивается доля низкомолекулярных фракций в полимере. Возрастает число побочных реакций, приводящих к образованию разветвленных молекул. Увеличивается нерегулярность при построении цепи полимера вследствие возрастания доли типов соединения мономера «голова к голове» и «хвост к хвосту».

Энергия активации роста ~ 6 ккал/моль;
Энергия активации инициирования ~30 ккал/моль;
Энергия активации обрыва ~8 ккал/моль.
Числитель (6-15-4 = -13) меньше нуля, значит с ростом температуры степень полимеризации уменьшается. В результате молекулярная масса полимера в целом уменьшается, увеличивается доля низкомолекулярных фракций в полимере.
V. Влияние давления на скорость полимеризации
Принцип Ле-Шателье: Если на систему оказывается внешнее воздействие, то в системе активируются процессы, ослабляющие это воздействие.

Чем выше давление, тем выше скорость радикальной полимеризации. Однако чтобы повлиять на свойства конденсированных систем, нужно прикладывать давление в несколько тысяч атмосфер.
Особенностью полимеризации под давлением является то, что увеличение скорости не сопровождается уменьшением молекулярной массы получаемого полимера.
Ингибиторы и замедлители полимеризации.
Явления обрыва и передачи цепи широко используются на практике для:
- предотвращения преждевременной полимеризации при хранении мономеров;
- для регулирования процесса полимеризации
В первом случае к мономерам добавляют ингибиторы или стабилизаторы , которые вызывают обрыв цепи, а сами превращаются в соединения, не способные инициировать полимеризацию. Также они разрушают пероксиды, образующиеся при взаимодействии мономера с атмосферным кислородом.
Ингибиторы : хиноны, ароматические амины, нитросоединения, фенолы.
Регуляторы полимеризации вызывают преждевременный обрыв материальной цепи, снижая молекулярную массу полимера пропорционально введенному количеству регулятора. Примером их являются меркаптаны.
Термодинамика радикальной полимеризации
Реакция роста цепи обратима, наряду с присоединением мономера к активному центру может происходить и его отщепление-деполимеризация.
Термодинамическая возможность полимеризации, как и любой другой равновесный химический процесс можно описать с помощью функций Гиббса и Гельмгольца:

Однако функция Гиббса наиболее приближена к реальным условиям, поэтому мы воспользуемся ей:
Так же изменение функции Гиббса связано с константой равновесия реакции уравнением:

Константа полимеризационно-деполимеризационного равновесия при достаточно большом молекулярном весе образующегося полимера (p>>1) зависит только от равновесной концентрации мономера:


Откуда следует, что

Из уравнения (а) можно найти такую температуру, при которой реакция полимеризации не будет идти, а из уравнения (б) можно найти равновесную концентрацию мономера, при превышении которой будет происходить полимеризация.
Влияние температуры
Для определения влияния температуры на равновесную концентрацию мы представим уравнение (б) в следующем виде:

В случае, когда ΔH°<0 и ΔS°<0 с ростом температуры увеличивается равновесная концентрация мономера. Верхний предел ограничен концентрацией мономера в массе. Это значит, что есть некоторая верхняя предельная температура - Т в.пр. , выше которой полимеризация невозможна.

В случае, когда ΔH°>0 и ΔS°>0 наблюдается обратная зависимость: с уменьшением температуры увеличивается равновесная концентрация мономера. Следовательно, для мономеров с отрицательным тепловым эффектом существует нижняя предельная температура Т н.пр.

Так же есть известные случаи, когда эти зависимости не пересекаются, но они не представляют практического интереса.

Термодинамическая вероятность
Теперь рассмотрим термодинамическую возможность протекания реакции, условием которой является равенство ΔG<0. Оно определяется как изменением энтальпии так и энтропии, причем вклад энтропийного члена будет изменяться с температурой реакции.

При полимеризации по кратным связям энтропия системы всегда уменьшается, т.е. процесс по энтропийным соображениям невыгоден. Слабая зависимость ∆S° от природы мономера связана с тем, что основной вклад в ∆S° вносит потеря поступательных степеней свободы молекул мономеров.

Но также известны мономеры, для которых при полимеризации происходит увеличение энтропии. Такое изменение ∆S° характерно для некоторых ненапряженных циклов. Причем, поскольку полимеризация оказывается выгодной с энтропийной точки зрения, она может протекать даже при отрицательных тепловых эффектах (полимеризация циклов S 8 и Se 8 с образованием линейных полимеров)
Расчеты и измерения энтропии для полимеризации большинства виниловых мономеров показывают, что ∆S° составляет около 120 Дж/К·моль.
Напротив, ∆Н° изменяется в зависимости от химического строения мономера в довольно широких пределах (∆Q° = −∆Н° варьируется от нескольких кДж/моль до 100 кДж/моль), что обусловлено различием природы кратной связи и ее заместителей. Отрицательные значения ∆Н° свидетельствуют о том, что полимеризация выгодна с точки зрения энтальпийного фактора. При обычных температурах порядка 25°С полимеризация термодинамически разрешима для мономеров, тепловой эффект которых превышает 40 кДж/моль. Это условие соблюдается для большинства виниловых мономеров. Однако, при полимеризации по С=О связи тепловые эффекты ниже 40 кДж/моль. Поэтому условие ∆G<0 соблюдается только при достаточно низких температурах, когда |TΔS°|<|ΔH°|.
Рассмотрим явление несоответствия теоретической и практической энтальпии полимеризации



Выделяется меньшее количество энергии, куда она девается?
- Разрушается эффект сопряжения;
- Стерическое отталкивание (при синтезе полистирола образуется спиральная молекула за счет стерического отталкивания).

Причина возрастания Q при полимеризации циклов - термодинамчески не выгодный валентный угол между гибридизованными орбиталями и отталкивание неподеленных электронных пар заместителя.
- Раскрытие цикла (ΔS 1 ° > 0)
- Рост цепи (ΔS 2 ° < 0)
ΔS° = ΔS 1 ° + ΔS 2 °, ΔS° может быть больше или меньше нуля.
План лекции:
1. Радикальная полимеризация.
2. Ионная полимеризация
Подавляющее большинство высокомолекулярных соединений получают в результате реакций полимеризации и поликонденсации.
Полимеризация
Полимеризация - это процесс получения полимеров, при котором построение макромолекул происходит путем последовательного присоединения молекул низкомолекулярного вещества (мономера) к активному центру, находящемуся на конце растущей цепи. Для полимеризации обязательными являются стадии инициирования и роста цепи.
Инициирование - это превращение небольшой доли молекул мономера М в активные центры AM*, способные присоединять к себе новые молекулы мономера. С этой целью в систему вводят возбудители (инициаторы I или катализаторы) полимеризации. Инициирование полимеризации можно представить таким образом:
Если в полимеризации участвует один мономер, то получают гомополимеры, если два или более - то сополимеры. В зависимости от природы активного центра различают радикальную и ионную полимеризацию исополимеризацию.
Радикальная полимеризация
Радикальная полимеризация всегда протекает по цепному механизму. Функции активных промежуточных продуктов при радикальной полимеризации выполняют свободные радикалы. К числу распространенных мономеров, вступающих в радикальную полимеризацию, относятся винильные мономеры: этилен, винилхлорид, винилацетат, винилиденхлорид, тетрафторэтилен, акрилонитрил, метакрилонитрил, метилакрилат, метилметакрилат, стирол и диеновые мономеры (бутадиен, изопрен, хлоропренидр.).
Радикальной полимеризации свойственны все признаки цепных реакций, известных в химии низкомолекулярных соединений (например, взаимодействие на свету хлора и водорода). Такими признаками являются: резкое влияние незначительного количества примесей на скорость процесса, наличие индукционного периода и протекание процесса через последовательность трех зависящих друг от друга стадий - образование активного центра (свободного радикала), рост цепи и обрыв цепи. Принципиальное отличие полимеризации от простых цепных реакций заключается в том, что на стадии роста кинетическая цепь воплощается в материальную цепь растущего макрорадикала, и эта цепь растет до образования макромолекулы полимера.
Инициирование радикальной полимеризации сводится к созданию в реакционной среде свободных радикалов, способных начать реакционные цепи. Стадия инициирования включает две реакции: возникновение первичных свободных радикалов инициатора R* (1а) и взаимодействие свободного радикала с молекулой мономера (16) с образованием радикала М*:

Реакция (1б) протекает во много раз быстрее, чем реакция (1а). Поэтому скорость инициирования полимеризации определяет реакция (1а), в результате которой генерируются свободные радикалы R*. Свободные радикалы, представляющие собой частицы с неспаренным электроном, могут образовываться из молекул под влиянием физического воздействия - теплоты, света, проникающей радиации, когда в них накапливается энергия, достаточная для разрыва π-связи. В зависимости от вида физического воздействия на мономер при инициировании (образование первичного радикала М*) радикальную полимеризацию подразделяют на термическую, радиационную и фотополимеризацию. Кроме того, инициирование может осуществляться за счет распада на радикалы специально вводимых в систему веществ - инициаторов. Этот способ называется вещественным инициированием.
Термическое инициирование заключается в самоинициировании при высоких температурах полимеризации чистых мономеров без введения в реакционную среду специальных инициаторов. В этом случае образование радикала происходит, как правило, вследствие разложения небольших количеств пероксидных примесей, которые могут возникать при взаимодействии мономера с кислородом воздуха. На практике таким путем получают так называемый блочный полистирол. Однако широкого распространения метод термического инициирования полимеризации не нашел, поскольку он требует больших затрат тепловой энергии, а скорость полимеризации в большинстве случаев невелика. Ее можно увеличить, повышая температуру, но при этом снижается молекулярная масса образующегося полимера.
Фотоинициирование полимеризации происходит при освещении мономера светом ртутной лампы, при котором молекула мономера поглощает квант света и переходит в возбужденное энергетическое состояние. Соударяясь с другой молекулой мономера, она дезактивируется, передавая последней часть своей энергии, при этом обе молекулы превращаются в свободные радикалы. Скорость фотополимеризации растет с увеличением интенсивности облучения и, в отличие от термической полимеризации, не зависит от температуры.
Радиационное инициирование полимеризации в принципе аналогично фотохимическому. Радиационное инициирование состоит в воздействии на мономеры излучений высокой энергии(γ -лучи, быстрые электроны,α- частицы, нейтроны и др.). Преимуществом фото- и радиационно-химического способов инициирования является возможность мгновенного «включения и выключения» излучения, а также проведение полимеризации при низких температурах.
Однако все эти способы технологически сложны и могут сопровождаться протеканием в получаемых полимерах побочных нежелательных реакций, например деструкции. Поэтому на практике чаще всего используют химическое (вещественное) инициирование полимеризации.
Химическое инициирование осуществляется введением в среду мономера низкомолекулярных нестойких веществ, имеющих в своем составе связи с низкой энергией - инициаторов, легко распадающихся на свободные радикалы под влиянием теплоты или света. Наиболее распространенными инициаторами радикальной полимеризации являются пероксиды и гидропероксиды (пероксид водорода, перок- сид бензоила, гидропероксидыmpem -бутила и изопропилбензола и др.), азо- и диазосоединения (динитрил азобисизомасляной кислоты, диазоаминобензол и др.), персульфаты калия и аммония. Ниже представлены реакции распада некоторых инициаторов.
Пероксид трет-бутила (алкилпероксид):


Активность и возможность применения инициаторов радикальной полимеризации определяется скоростью их разложения, которая зависит от температуры. Выбор конкретного инициатора обусловливается той температурой, которая необходима для проведения синтеза полимера. Так, динитрил азобисизомасляной кислоты применяют при 50-70 °С, пероксид бензоила - при 80-95°С, а пероксид трет- бутила - при 120-140°С.
Эффективными инициаторами, позволяющими проводить процесс радикальной полимеризации при комнатной и пониженной температурах, являются окислительно-восстановительные системы. В качестве окислителей используют обычно пероксиды, гидропероксиды, персульфаты и др. Восстановителями являются соли металлов переменной валентности (Fe, Со, Сu) в низшей степени окисления, сульфиты, амины и др.
Вопросы для самопроверки:
1. Какие вещества являются инициаторами радикальной полимеризации?
2. К чему сводится инициирование радикальной полимеризации?
3. Виды инициирования.
4. Что такое полимеризация?
Лекция 6. Сополимеризация.
План лекции:
1.Сополимеризация
2. Технические способы проведения гомо- и сополимеризации.
Сополимеризация
Сополимеризация заключается в получении высокомолекулярных веществ из смеси двух или более мономеров, которые называются сомономерами, а само вещество - сополимером. Макромолекулы сополимеров состоят из элементарных звеньев всех мономеров, присутствующих в исходной реакционной смеси. Каждый сомономер придает сополимеру, в состав которого он входит, свои свойства, при этом свойства сополимера не являются простой суммой свойств отдельных гомополимеров. Так, содержание небольшого количества стирола в цепях поливинилацетата повышает температуру стеклования последнего, устраняет свойство хладотекучести и увеличивает его поверхностную твердость.
Закономерности сополимеризации значительно сложнее, чем закономерности гомополимеризации. Если при гомополимеризации имеется один тип растущего радикала и один мономер, то при бинарной сополимеризации, в которой участвует всего два мономера, существует по крайней мере четыре типа растущих радикалов. Действительно, если два мономера А и В взаимодействуют со свободными радикалаи R", возникшими при распаде инициатора, образуются первичные радикалы, один из которых имеет концевое звено А, а второй - В:

Каждый первичный радикал может реагировать как с мономером А, так и с мономером В:

Отношение константы скорости реакции каждого радикала со «своим» мономером к константе скорости реакции с «чужим» мономером называют константами сополимеризации или относительными активностями мономеров:
Величины r А и r в определяют состав макромолекул сополимера в большей мере, чем соотношение мономеров в исходной реакционной смеси. Например, в паре винилацетат (А)-стирол (В) константы сополимеризации составляют r А = 0,01, r в = 55. Это означает, что при получении сополимера полимеризацией в массе и растворителе макромолекулы содержат существенно больше звеньев стирола, чем винилацетата. Если относительные активности сомономеров близки к единице, то каждый радикал с равной вероятностью взаимодействует как со «своим», так и с «чужим» мономером. Включение мономеров в цепь при этом носит случайный характер, и образуется статистический сополимер. Такую сополимеризацию называют идеальной. Примером системы, близкой к идеальной, является пара бутадиен-стирол.
Реакции сополимеризации могут протекать как по радикальному, так и по ионному механизму. При ионной сополимеризации на константы сополимеризации оказывает влияние природа катализатора и растворителя. Поэтому сополимеры, получаемые из одних и тех же сомономеров при одинаковом исходном соотношении в присутствии разных катализаторов, имеют разный химический состав. Так, сополимер стирола и акрилонитрила, синтезированный из эквимолярной смеси мономеров в присутствии пероксида бензоила, содержит 58 % стирольных звеньев. Вместе с тем при анионной сополимеризации на катализаторе C 6 H 5 MgBr содержание в макромолекулах звеньев стирола составляет 1 %, а при катионной полимеризации в присутствии SnCl 4 - 99 %.
В практическом отношении интересны блок- и привитые сополимеры. В макромолекулах этих сополимеров существуют участки большой протяженности из звеньев каждого сомономера.
Блок-сополимеры получают разными методами. Во-первых, при анионной полимеризации одного мономера возникающие «живые» цепи, то есть макроанионы, могут инициировать полимеризацию другого мономера:
Во-вторых, при интенсивном механическом воздействии на смесь разных полимеров происходит деструкция цепей и образование макрорадикалов. Макрорадикалы, взаимодействуя между собой, формируют блок-сополимер.
Блок-сополимеры могут образовываться также из олигомеров за счет взаимодействия концевых групп.
Привитые сополимеры получают, как правило, взаимодействием мономера с полимером и реже взаимодействием двух разных полимеров между собой. Так как в этих процессах используется реакция передачи цепи с превращением полимерных молекул в макрорадикалы, в состав макромолекул часто вводят атомы или группы с повышенной подвижностью (например, бром), что ускоряет реакцию передачи цени. Так, если в реакционной среде находится полимер на основе мономера СН 2 =СНХ, мономер СН 2 =CHY и инициатор, процесс образования привитого сополимера протекает следующим образом. Сначала возникает серединный макрорадикал:
Затем этот макрорадикал инициирует полимеризацию мономера с образованием боковых ветвей:

Получение блок- и привитых сополимеров почти всегда сопровождается образованием томополимера из присутствующего в зоне реакции мономера.